Propè
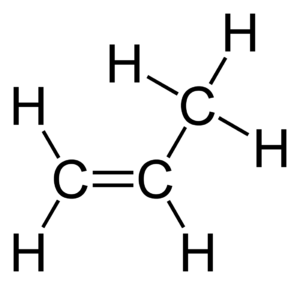
El propè o propilè (també propé i propilé[1]) és un compost químic del grup dels hidrocarburs, la qual molècula està constituïda per tres àtoms de carboni, dos d'ells enllaçats amb un enllaç covalent doble i l'altre per un enllaç covalent simple a un dels altres dos, i sis àtoms d'hidrogen enllaçats als carbonis, la qual fórmula molecular és . És un alquè, un hidrocarbur insaturat. En condicions normals és un gas inodor i incolor. És un compost relativament no tòxic. És el segon compost orgànic més produït a escala industrial.
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 42,04695 Da |
| Trobat en el tàxon | |
| Estructura química | |
| Fórmula química | C₃H₆ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Moment dipolar elèctric | 0,366 D |
| Punt de fusió | −185,25 °C |
| Punt d'ebullició | −47,69 °C (a 101,325 kPa) |
| Moment dipolar elèctric | 0,366 D |
| Perill | |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Identificador Kemler | 23 |
Estat natural i obtenció modifica
El propè només es troba a la natura en quantitats de traça. No forma part del gas natural ni del petroli, com altres hidrocarburs.[2] El propè es troba present a l'atmosfera en concentracions que arriben a 8,2 μg/m³ en llocs remots. Tanmateix, les concentracions poden variar de més de 150 μg/m³ als centres urbans, principalment a causa de les emissions dels gasos d’escapament d’automòbils, plantes químiques i altres instal·lacions industrials. El propè s'ha detectat en aigües marines i dolces en traces: fins a 9,3 × 10–7 ml/L en aigües marines i 0,5 mg/L en aigües dolces.[3]
Les fonts de propè detectat a l'atmosfera són: els incendis forestals o la crema de biomassa; la combustió incompleta dels combustibles als motors d'explosió dels vehices; la vegetació durant les hores de clarors (procés fotosintètic); la mar, estan el propè associat a la degradació fotoquímica del carboni orgànic; els sòls, poguen estar associat a alguna degradació bacteriana; i emissions industrials.[4]
Com que el propè no és lipofílic, és poc probable que es produeixi bioacumulació. Se suposa que el propè es degrada ràpidament a l'atmosfera, ja que reacciona amb els radicals hidroxil produïts fotoquímicament. Aquest procés té una vida mitjana d’unes 14,6 hores. Els radicals nitrats i l'ozó també provocaran una degradació del propè, tot i que a un ritme més lent.[3]
A l'espai es detectà propè el 2007 al núvol molecular de Taure (TMC-1), situat a les constel·lacions del Taure i de l'Auriga.[5] El 2013 fou identificat a l'estratosfera de Tità, la lluna més grossa de Saturn.[6]
Obtenció modifica
El 2015 la producció mundial fou de 94 milions de tones (27 a la zona Àsia-Pacífic, 15 a Europa, 13 als EUA i 7,5 a l'Orient Mitjà). Durant molts anys, el propè s'ha produït mitjançant dos processos:
- craqueig del vapor de nafta (el 2010 el 56 % de la producció)
- craqueig catalític del gasoil (el 2010 el 37 % de la producció)
Ambdós processos produeixen una mescla complexa de productes amb abundància d'etè. Com que la quantitat de propè necessària en comparació amb la d'etè ha augmentat, s'han posat en funcionament nous mètodes. S'espera que el 2020 aquests representin un 25 % del total de la producció, davallant els altres a un 42 % i un 37 %, respectivament.[7]
Craqueig catalític del propà modifica
Cada vegada més s’està craquejant catalíticament el propà per formar propè, utilitzant el mateix catalitzador del craqueig de gasoil. La reacció és:[7]
Procés MTO modifica
El procés MTO (methanol to olefin) converteix metanol en etè i propè mitjançant l'obtenció intermèdia de dimetil èter. El vapor de metanol es passa per l'alúmina, , a 600 K aproximadament, i es produeix una barreja en equilibri de metanol, dimetil èter i vapor d'aigua, que conté aproximadament un 25% de metanol. La següent etapa produeix alquens. Mitjançant l’ús d’una zeolita tractada amb àcid, gairebé tot l’alquè produït és transforma en propè. El propè es purifica refredant-lo i sotmetent el líquid obtingut a una destil·lació fraccionada.[7] La primera etapa és:
Reacció entre etè i butè modifica
L'etè es pot obtenir per deshidratació de bioetanol mitjançant un catalitzador de sílice/alúmina o alúmina, . Els butens (but-1-è i but-2-è) s'obtenen per deshidratació de biobutanol o per dimerització de bioetè. La dimerització de l'etè a but-1-è es duu a terme passant etè escalfat sobre una zeolita impregnada amb un complex de metalls de transició (rodi, titani i altres):[7]
A continuació, s’escalfa la barreja d’etè i butè i es passa per sobre d’un catalitzador sòlid a base de composts orgànics de molibdè(IV) i tungstè(IV) (catalitzadors de Schrock) i composts organo-ruteni(II) (catalitzadors de Grubbs), produint-se la reacció:[7]
Estructura molecular modifica
La molècula de propè és una molècula la qual estructura està condicionada per l'enllaç covalent doble C=C entre dos dels seus carbonis. L'altre enllaç entre carbonis és simple. L'enllaç doble impedeix la rotació de la molècula, per la qual cosa els tres àtoms de carboni estan continguts en un pla formant un angle de 124,3°. Les longituds dels enllaços són 133,6 pm l'enllaç doble C=C i 150,1 pm l'enllaç simple C–C. Els àtoms d'hidrogen estan enllaçats als carbonis per enllaços covalents simples.[8]
Propietats modifica
Propietats físiques modifica
A temperatura ambient el propè és un gas incolor amb una feble olor de petroli. El seu punt de fusió és de –185,3 °C i el d'ebullició –47,68 °C. És 1,46 vegades més dens que l'aire. És inflamable, amb un punt d'ignició de –108 °C i un punt d'inflamabilitat de 445 °C. És molt soluble en etanol i àcid acètic, i soluble en aigua (200 mg/L).[9]
Propietats químiques modifica
Hidratació modifica
La reacció d'hidratació és una reacció d'addició d'aigua al doble enllaç catalitzada per un àcid, àcid sulfúric, , o àcid fosfòric, . S'obté propan-2-ol d'acord amb la regla de Markóvnikov (un hidrogen de l'aigua s'addiciona al carboni amb més hidrògens i el grup hidroxil, , a l'altre carboni del doble enllaç). La reacció requereix temperatures d'uns 250 °C i un pH elevat. S'empra industrialment.[10]
Oximercuració modifica
La reacció d'hidratació requereix condicions d'altes temperatures difícils d'aconseguir en els laboratoris. L'addició d'un grup hidroxil, , es pot dur a terme mitjançant la reacció d'oximercuració en condicions més suaus. Primer es duu a terme una reacció amb etanoat de mercuri(II) dissolt en tetrahidrofurà aquós, formant-se un complex organometàl·lic de mercuri. Seguidament es fa reaccionar amb borohidrur de sodi, , i s'obté propan-2-ol.
Hidroboració modifica
La hidroboració és una reacció on s'addiciona un trihidrur de bor o borà, , al propè i s'obté un organoborà. El producte obtingut és anti-Markóvnikov. Seguidament es pot oxidar aquest compost mitjançant peròxid d'hidrogen en medi bàsic i s'obté el propan-1-ol.[10]
Dihidroxilació modifica
La reacció d'hidroxilació consisteix en l'addició de dos grups hidroxil, , un a cada carboni del doble enllaç. S'empra com a reactiu peròxid d'hidrogen, , i requereix emprar com a catalitzador òxid d'osmi(VIII), , car i tòxic. Es forma un producte intermediari, un osmat que es pot tractar amb hidrogensulfit de sodi, , i dona el propan-1,2-diol.[10]
Halogenació modifica
L'halogenació consisteix en l'addició electròfila d'una molècula d'un halogen ( , , o ) al doble enllaç, formant-se un derivat dihalogenat, amb un àtom d'halogen addicionat a cadascun dels carbonis que formen el doble enllaç. En el cas del propè si l'halogen és el brom es forma 1,2-dibromopropà.[10]
Addició d'halurs d'hidrogen modifica
L'addició d'un halur d'hidrogen ( , , o ) dona lloc a un haloalcà. Es formen dos productes, si s'addiciona bromur d'hidrogen s'obté un 90 % de 2-bromopropà i un 10 % d'1-bromopropà, seguint la regla de Markóvnikov.[10]
En cas que la reacció tengui lloc en presència de peròxids orgànics, s'obté majoritàriament el producte anti-Markóvnikov.[10]
Addició d'àcids hipohalurosos modifica
L'àcid hipoclorós i l'àcid hipobromós poden addicionar-se al doble enllaç formant halohidrines, això és un compost amb un halogen enllaçat a un carboni i un grup hidroxil, , al carboni veí.[10]
Hidrogenació modifica
El propè pot reduir-se a propà mitjançant hidrogenació fent passar un corrent d'hidrogen sobre un catalitzador. El platí i el pal·ladi són els catalitzadors més comuns per a la hidrogenació dels alquens; el pal·ladi s’utilitza en general en forma de pols molt fi “suportat” en un material inert com el carbó vegetal (Pd/C) per maximitzar l’àrea superficial. El platí s’utilitza habitualment com òxid de platí(IV), , un catalitzador anomenat catalitzador d'Adams.[10]
Epoxidació modifica
Els alquens s'oxiden per donar epòxids en el tractament amb un peroxoàcid, , com l'àcid meta-cloroperoxobenzoic. Un epòxid, també anomenat oxirà, és un èter cíclic amb un àtom d'oxigen en un anell de tres membres.[10] En el cas del propè es forma òxid de propè o 1,2-epoxipropà, un compost de gran importància industrial.
Oxidació modifica
L'oxidació pot tenir lloc emprant ozó, , o permanganat de potassi, . L'ozó, preparat passant un flux d'oxigen a través d'una descàrrega elèctrica d'alt voltatge, s'addiciona ràpidament al propè a baixes temperatures per donar un intermediari cíclic anomenat molozònid. Aquest es transposa espontàniament per formar un ozònid que es tracta immediatament amb un agent reductor com el zinc metàl·lic en àcid acètic per convertir-lo en metanal i etanal, dos aldehids.[10]
Mitjançant la reacció amb permanganat de potassi en medi àcid o neutre s'obté també la ruptura del doble enllaç i la formació, en aquest cas, d'àcid etanoic i diòxid de carboni.[10]
Polimerització modifica
La polimerització consisteix a unir molècules de propè, una rere l'altra, donant polipropilè, un dels composts més importants de la societat actual. La polimerització es pot fer de forma radicalària encara que amb la polimerització catalítica s'obtenen productes amb millors qualitats i més controlables. Els catalitzadors emprats eren originalment del tipus Ziegler-Natta. Actualment s'estan substituint per altres sistemes basats en zirconocè.[2]
Aplicacions modifica
L'aplicació més important del propè és la síntesi de polipropilè, representant un 67 % de l'ús del propè. Altres productes que se sintetitzen a partir d'ell són: òxid de propè (7 %), propenonitril (6 %), àcid propenoic (5 %), (1-metiletil)-benzè (4 %) i butanol (3 %).[7]
Toxicitat modifica
El propè és relativament poc tòxic per als humans i s’ha investigat per utilitzar-lo com a anestèsic. La seva inflamabilitat i explosivitat, però, han indicat que aquesta aplicació no era adequada. L'exposició a una concentració del 6,4% durant 2,25 minuts provoca una intoxicació lleu, una sensació d’entumiment i una incapacitat per concentrar-se. Al 12,8% durant 1 min, aquests mateixos símptomes són més acusats, amb un 24 i un 33 % durant 3 min, resultant en inconsciència. Les exposicions del 40 al 75% durant uns minuts provoquen enrogiment de les parpelles, rubor a la cara, esquinçament i tos. Això és coherent amb el fet que el propè liquat pot causar cremades a la pell en contacte directe. Tanmateix, igual que amb qualsevol asfixiant, les exposicions elevades durant un temps suficient, que resulten en privació d’oxigen, poden provocar la mort.[11]
Referències modifica
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Propè |
- ↑ Propilé i propé segons la pronúncia occidental i propilè i propè segons la pronúncia oriental. Per a més informació, consulteu el Llibre d'estil
- ↑ 2,0 2,1 Myers, Richard L. The 100 most important chemical compounds : a reference guide. Westport, Conn.: Greenwood Press, 2007. ISBN 978-0-313-08057-9.
- ↑ 3,0 3,1 Williams, Lawrence R. «Chapter 30 - Wildlife Toxicity Assessment for Propylene». A: Wildlife Toxicity Assessments for Chemicals of Military Concern (en anglès). Elsevier, 2015, p. 581–590. DOI 10.1016/b978-0-12-800020-5.00030-2. ISBN 978-0-12-800020-5.
- ↑ Morgott, David «The Human Exposure Potential from Propylene Releases to the Environment» (en anglès). International Journal of Environmental Research and Public Health, 15, 1, 04-01-2018, pàg. 66. DOI: 10.3390/ijerph15010066. ISSN: 1660-4601. PMC: PMC5800165. PMID: 29300328.
- ↑ Marcelino, N.; Cernicharo, J.; Agúndez, M.; Roueff, E.; Gerin, M. «Discovery of Interstellar Propylene (CH₂CHCH₃): Missing Links in Interstellar Gas-Phase Chemistry». The Astrophysical Journal, 665, 2, 10-08-2007, pàg. L127–L130. DOI: 10.1086/521398. ISSN: 0004-637X.
- ↑ Nixon, C. A.; Jennings, D. E.; Bézard, B.; Vinatier, S.; Teanby, N. A. «DETECTION OF PROPENE IN TITAN'S STRATOSPHERE». The Astrophysical Journal, 776, 1, 30-09-2013, pàg. L14. DOI: 10.1088/2041-8205/776/1/L14. ISSN: 2041-8205.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 «Propene (Propylene)» (en anglès britànic). [Consulta: 25 març 2021].
- ↑ Lide, David R.; Christensen, Daniel «Molecular Structure of Propylene». The Journal of Chemical Physics, 35, 4, 01-10-1961, pàg. 1374–1378. DOI: 10.1063/1.1732055. ISSN: 0021-9606.
- ↑ PubChem. «Propylene» (en anglès). [Consulta: 25 març 2021].
- ↑ 10,00 10,01 10,02 10,03 10,04 10,05 10,06 10,07 10,08 10,09 10,10 McMurry, John. Química orgánica. 8a ed. México: Cengage Learning, 2012. ISBN 607-481-789-8.
- ↑ Bolt, H. M.. «Propene». A: Encyclopedia of Toxicology (en anglès). 10a. Oxford: Academic Press, 2014, p. 1099–1100. DOI 10.1016/b978-0-12-386454-3.00424-3. ISBN 978-0-12-386455-0.
