Bisulfit
L'ió bisulfit (la nomenclatura recomanada per IUPAC éssulfit d'hidrogen) és l'ió HSO₃−. Les sals que contenen l'ió HSO₃− es diuen bisulfits. Per exemple, el bisulfit de sodi és NaHSO₃.
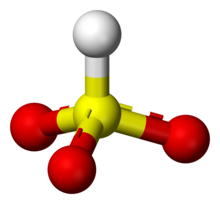
Estructura modifica
Algunes proves poden suggerir que el protó en ions de bisulfit es troba en sofre, donant lloc a la simetria molecular simetria de C3v.
Reaccions modifica
Les sals de bisulfit típicament es preparen pel tractament de solucions alcalines amb excés de diòxid de sofre:
- SO₂ + NaOH → NaHSO₃
HSO₃− és la base conjugada d'àcid sulfurós, H₂SO₃:
- H₂SO₃ ⇌ HSO₃− + H+
Un equilibri més consistent ambl'espectroscopia és :
- SO₂ + H₂O ⇌ HSO₃− + H+
HSO₃− és un àcid feble amb una constant àcida de dissociació pKa de 6,97. La seva base conjugada és l'ió sulfit SO₃2−:
- HSO₃− ⇌ SO₃2− + H+
agents reductors, com tots els sulfits i el diòxid de sofre, els quals contenen sofre en el mateix estadi d'oxidació (+4).
Medicina modifica
Les sals bisulfit són additius comuns en l'epinefrina per tal d'evitar-ne l'oxidació a adrenochrome i resultar la inactivació. Els bisulfits poden de vegades causar una reacció al·lèrgica.[1]
Referències modifica
- ↑ Fraser, W. A.; Huang, A. S. «Are sulfites additives really safe?». New England Journal of Medicine, 311, 8, 1984, pàg. 542. DOI: 10.1056/NEJM198408233110824.