ATPases tipus P
Les ATPases tipus P, també conegudes com a E1-E2 ATPases, són un grup gran de bombes de ions relacionades evolutivament que es troben en bacteris, arqueobacteris i eucariotes. Són transportadors actius en forma d'hèlix α que reben el nom d'ATPases tipus P perquè catalitzen l'autofosforilació d'un residu d'aspartat clau de la mateixa bomba. A més a més totes coincideixen en el menys 2 tipus diferents de conformacions anomenades E1 i E2. La majoria dels membres d'aquesta família són específics pel bombament d'una llarga sèrie de cations, tot i que hi ha una subfamília que està involucrada en el “flipping” de fosfolípids per mantenir la natura asimètrica de la biomembrana. Els exemples més destacats d'ATPases tipus P són la bomba de sodi-potassi (Na+,K+-ATPasa), la bomba de protons (H+-ATPasa), la bomba de protons-potassi(H+,K+-ATPasa) i la bomba de calci (Ca2+-ATPasa).
Descobriment modifica
La primera ATPasa tipus P descoberta va ser la Na+, K+-ATPasa, la qual va ser aïllada l'any 1957[1] per Jen Christian Skou, guanyador d'un Premi Nobel. La Na+,K+-ATPasa era només el primer membre d'una gran família de proteïnes que encara segueix creixent, i que al juny del 2007, tenia a prop de 400 membre confirmats a Swiss-Prot. (Prosite motif PS00154).
Classificació filogenètica modifica
Una anàlisi filogenètica de 159 seqüències feta l'any 1998 per Axelsen I Palmgreen va demostrar que les ATPases de tipus P es poden dividir en 5 subfamílies, basant-se estrictament en una seqüència gra conservativa excloent les altament variables regions N i C terminal. L'anàlisi filogenètica, va agrupar les proteïnes independentment de l'organisme del qual eren aïllades i va demostrar que la diversificació de la família de les ATPases tipus P va tenir lloc abans de la separació de bacteris, arqueobacteris i eucariotes. Això remarca la importància d'aquesta família de proteïnes per a la supervivència de la cèl·lula.[2]
- Tipus I Consisteix en les ATPases dels metalls pesants i de transició.
- Tipus IA estan involucrades en la importació de K+. Són ATPases tipus P atípiques perquè, a diferència de les altres ATPases tipus P, funcionen com a part d'un heterotetramèric complex (anomenat KdpFABC), on de fet el transport de K+ és mitjançat per un altre subcomponent del complex.
- Tipus IB estan involucrades en el transport d'àcids Lewis febles: Cu+, Ag+, Cu2+, Zn2+, Cd2+, Pb2+ and Co2+. Són elements claus per a la resistència dels metalls i per a l'homeòstasi dels metalls en un ampli rang d'organismes.
- Tipus II Estan dividides en 4 grups.
- Tipus IIA transporta Ca2+. SERCA1a és un tipus de bomba IIA.
- Tipus IIB transporta Ca2+.
- Tipus IIC consta de les estretament relacionades Na+/K+ i H+/K+ ATPases de les cèl·lules animals.
- Tipus IID consta d'un petit nombre d'ATPases de fongs de funcions desconegudes.
- Tipus III consta de les H+-ATPases de la membrana plasmàtica de plantes I fongs (IIIA) i una petita subdivisió amb Mg2+-ATPases de 3 espècies bacterianes (IIIB).
- Tipus IV s'han vist que estan involucrades en el transport de fosfolípids.[3] Tot I això l'especificitat del transport de les ATPases tipus P-IV encara és un tema polèmic.
- Tipus V tenen una especificitat desconeguda. Aquest gran grup només es troba en eucariotes i es creu que estan involucrades en el transport de cations al reticle endoplasmàtic.
Gens Humans modifica
Els gens humans que codifiquen ATPases tipus P o proteïnes semblants a les ATPases tipus P inclouen:
- Transport de Na+/K+: ATP1A1, ATP1A2, ATP1A3, ATP1A4, ATP1B1, ATP1B2, ATP1B3, ATP1B4
- Transport de Ca2+: ATP2A1, ATP2A2, ATP2A3, ATP2B1, ATP2B2, ATP2B3, ATP2B4, ATP2C1
- Transport de Cu2+: ATP7A, ATP7B
- Classe I, tipus 8: ATP8A1, ATP8B1, ATP8B2, ATP8B3, ATP8B4
- Classe II, tipus 9: ATP9A, ATP9B
- Classe V, tipus 10: ATP10A, ATP10B, ATP10D
- Classe VI, tipus 11: ATP11A, ATP11B, ATP11C
- Transport no gàstric de H+/K+: ATP12A
- Tipus 13: ATP13A1, ATP13A2, ATP13A3, ATP13A4, ATP13A5
- ATP2C2;
- ATP4A;
- KIAA0195
Origen evolutiu modifica
Un dels marcs de lectura oberts en el genoma de l'arqueobacteri Methanococcus jannaschii mereix especial atenció, perquè pot desvetllar informació sobre l'evolució de l'ancestre de l'ATPasa tipus P. Aquest marc de lectura oberts, cobreix el gran llaç citoplasmàtic que és comú en totes les ATPases tipus P, el qual contés tots els aminoàcids involucrats en la unió de l'ATP i la hidròlisi. S'ha especulat que aquesta proteïna soluble es va fusionar amb un canal d'ions, creant així la primera ATPasa tipus P[4]
Estructura modifica
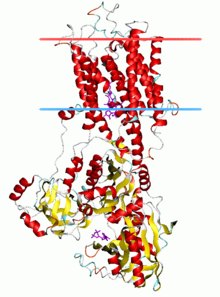
La majoria del nostre coneixements sobre l'estructura i el funcionament de les ATPAses tipus P prové de la SERCA1a, una Ca2+-ATPasa del reticle sarco(endo)plasmàtic de músculs de fibra ràpida de conill adult. Està generalment acceptat que per la família de les ATPases tipus P l'estructura de la SERCA1a és representativa[5]
Les estructures de les Na+/K+-ATPases I les H+-ATPases són també acceptades.
Estructura de la SERCA1a modifica
La SERCA1a està composta d'una secció citoplasmàtica i una secció transmembrana amb 2 llocs d'unió al Ca2+. La secció citoplasmàtic consisteix en 3 dominis citoplasmàtics anomenat dominis P,N, i A, i que contenen més de la meitat de la massa de la proteïna. La secció transmembrana té 10 hèlix transmembrana (M1-M10), amb 2 llocs d'unió al Ca2+ situats a prop del mig de la bicapa. Els llocs d'unió estan formats per cadenes laterals i carbonils de M4, M5, M6 i M8. M4 està desplegada en aquesta gràcies a una prolina conservada (P308). Aquest desplegament de M$ és reconegut com un tret clau de l'estructura de les ATPases tipus P. El domini P conté els canònics àcid aspàrtic i àcid fosforilat durant el cicle de la reacció. Està composta de 2 parts amplament separades en la seqüència. Aquestes 2 parts s'organitzen en 7 fulles β paral·leles amb 8 hèlix α associades formant el plegament Rossmann. El domini N es troba inserit entre 2 segments del domini P I està format per set fulles β antiparal·leles situades entre 2 acumulacions d'hèlix. Aquest domini conté la regió d'unió a l'ATP, apuntant cap al substrat a prop del domini P. El domini A és el més petit dels 3 dominis. Consisteix d'una estructura en forma de rotllet gelatinós amb 2 hèlix curtes. És el domini que actua modulant l'oclusió del Ca2+ en els llocs d'unió transmembrana, i és fonamental en transposar l'energia de la hidròlisi de l'ATP als dominis citoplasmàtics mitjançant transport vectorial de cations fins als dominis transmembrana. El domini A desfosoforila el domini P com a part del cicle de la reacció utilitzant un altament conservat TGES localitzat a un extrem del rotllet gelatinós. La hidròlisi de l'ATP té lloc al casc citoplasmàtic a la interfície entre els dominis N i P. Dos llocs d'unió al io magnesi formen part del centre actiu. Com s'ha mencionat abans, la hidròlisi de l'ATP està estretament acoblada a la translocació de Ca2+ a través de la membrana, a més de 40 Å, a prop del domini A.[6] Interessantment, el patró de plegament i les localitzacions d'aminoàcids crítics per a la fosforilació a les ATPases tipus P, té la característica de plegament haloàcid deshidrogenasa, de la superfamília de les haloacid deshidrogenases (HAD), tal com va ser predit per homologia de seqüències. La superfamília de les HAD funciona amb la comuna formació d'un ester d'aspartat per un mecanisme basat en la reacció SN2. Aquesta reacció SN2 es pot observar clarament en l'estructura de la SERCA amb ADP més AlF4-.[7]
Diferències amb la SERCA1a modifica
Diverses subfamílies de les ATPases tipus P també necessiten subunitats addicionals per un funcionament correcte. Tant les bombes P-IA com les P-IV necessiten subunitats extra per funcionar. La unitat funcional de la Na+/K+ ATPasa consta de 2 subunitats addicionals, beta i gamma, involucrades en el tràfic, el plegament, i la regulació d'aquestes bombes. SERCA1a i altres P-IIA ATPases estan també regulades per fosfolamban in sarcolipin in vivo. Probablement altres subfamílies també necessiten altres subunitats addicionals per al correcte funcionament in vivo. Alguns membres de la família tenen dominis addicionals fusionats a la bomba. Bombes de metalls pesants poden tenir diversos N i C-terminal llocs d'unió a metalls pesants que s'ha trobat que estan involucrats en processos de regulació. Les bombes de protons (IIIA) tenen un domini regulador al C-terminal (anomenat domini R) el qual, quan està desfosforilat, inhibeix el bombatge. Mentre que la majoria de subfamílies té 10 hèlix transmembrana hi ha algunes excepcions notables. La P-IA ATPasa té 7, i la gran família de bombes de metalls pesants té 8 hèlix transmembrana. El tipus V té un total de 12 hèlix transmembrana.
Mecanisme modifica
Tots els tipus d'ATPases tipus P utilitzen l'energia derivada de l'ATP per dur a terme el transport vectorial. Formen un intermediari aspartil-fosfoanhídrid d'alta energia en el cicle de reaccions, i es van convertint en com a mínim 2 conformacions diferents anomenades E1i E2. El coneixement d'E1 i E2 ve dels estudis inicials en aquesta família d'enzims fets en les Na+,K+-ATPases, on la forma del sodi i la forma del potassi es refereixen a E1 i E2, en l'esquema “Post-Albers”. Mentre que s'ha demostrat que l'esquema E1-E2 val la pena, s'hauria d'emfatitzar que existeixen més de 2 estats conformacionals, per tant, la notació no s'hauria de prendre de forma massa literal. Tot i això la notació remarca l'especificitat de l'enzim; en E1 la bomba té una alta afinitat pel substrat exportat i una baixa afinitat pel substrat importat, i a E2 té una baixa afinitat pel substrat exportat i una alta afinitat pel substrat importat. Ara sembla clar que 4 estats bàsics són les pedres angulars del cicle de reaccions, entre els quals hi ha diversos intermediaris interposats d'altres reaccions. Aquests són E1~P, E2P, E2-P* i E1/E2 I són descrits més endavant. En el cas de la SERCA1a, l'energia de l'ATP és utilitzada per a transportar 2 ions Ca2+-ions des del costat citoplasmàtic al reticle sarcoplasmàtic, i per contra-transportar entre 1 i 3 protons cap al citoplasma. Començant a l'estat E1/E2, el cicle de reaccions comença quan l'enzim allibera entre 1 o 3 protons dels residus units a cations, com a intercanvi d'ions citoplasmàtics de Ca2+. Això condueix a l'organització del lloc de la fosforilació entre domini N unit a l'ATP i el domini P, mentre que el domini A dirigeix l'oclusió de l'enllaç Ca2+. En aquest estat ocluït, els ions de Ca2+ són enterrats en un ions entorn proteic sense accés a cap dels 2 costats de la membrana. L'estat es forma a través d'una reacció cinasa on el domini P és fosforilat, produint ADP. La formació de l'enllaç β-fosforilat, allibera la γ-fosfat de l'ADP i deixa anar el domini N del domini P. Això permet que posteriorment el domini A roti cap al lloc de fosforilació, creant una associació forta tant amb el domini P com amb el domini N. Aquest moviment del domini A exerceix una força cap a baix sobre M3-M4 i arrossega M1-M2, forçant la bomba a obrir-se al costat luminal i formant l'estat E2P. Durant la transició de luminal Ca2+ transmembrana, els residus covalents són forçats a part, destruint l'alta afinitat del lloc d'unió. Aquest és un acord amb el model general de translocació de substrat (cf. 1.2), ensenyants que l'energia en el transport primari no s'utilitza per unir el substrat sinó per alliberar-la un altre cop dels ions enterrats. Alhora, el domini N s'exposa al citosol, preparat per l'intercanvi d'ATP al lloc d'unió del nucleòtid. Mentres el Ca2+ es dissocia del costat luminal, els llocs d'unió de cations són neutralitzats per la unió de protons, i això dona lloc a un tancament favorable dels fragments transmembrana. Aquest tancament juntament amb una rotació cap avall del domini A i un moviment del domini P, porta cap a l'estat ocluït E2-P*. Mentrestant, el domini N intercanvia ADP per ATP. El domini P és desfosforilat pel domini A, i el cicle es completa quan el fosfat és alliberat de l'enzim, estimulat pel novament format ATP, mentres una via citoplasmàtica s'obre per a intercanviar protons amb 2 nous ions Ca2+.[8]
Vegeu també modifica
Notes i referències modifica
- ↑ [SKOU JC (February 1957). "The influence of some cations on an adenosine triphosphatase from peripheral nerves". Biochim. Biophys. Acta 23 (2): 394–401. PMID: 13412736
- ↑ [Axelsen KB, Palmgren MG (January 1998). "Evolution of substrate specificities in the P-type ATPase superfamily". J. Mol. Evol. 46 (1): 84–101. PMID: 9419228. http://link.springer-ny.com/link/service/journals/00239/bibs/46n1p84.html Arxivat 2000-09-15 a Wayback Machine..
- ↑ [Lenoir G, Williamson P, Holthuis JC (December 2007). "On the origin of lipid asymmetry: the flip side of ion transport". Curr Opin Chem Biol 11 (6): 654–61. doi:10.1016/j.cbpa.2007.09.008. PMID: 17981493
- ↑ [Ogawa H, Haga T, Toyoshima C (April 2000). "Soluble P-type ATPase from an archaeon, Methanococcus jannaschii". FEBS Lett. 471 (1): 99–102. PMID: 10760521. http://linkinghub.elsevier.com/retrieve/pii/S0014-5793(00)01374-0.
- ↑ [Stokes DL, Green NM (2003). "Structure and function of the calcium pump". Annu Rev Biophys Biomol Struct 32: 445–68. doi:10.1146/annurev.biophys.32.110601.142433. PMID: 12598367
- ↑ [Toyoshima C, Nakasako M, Nomura H, Ogawa H (June 2000). "Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 A resolution". Nature 405 (6787): 647–55. doi:10.1038/35015017. PMID: 10864315
- ↑ [PDB 1T5T; Sørensen TL, Møller JV, Nissen P (June 2004). "Phosphoryl transfer and calcium ion occlusion in the calcium pump". Science 304 (5677): 1672–5. doi:10.1126/science.1099366. PMID: 15192230
- ↑ [Olesen C, Picard M, Winther AM, et al (December 2007). "The structural basis of calcium transport by the calcium pump". Nature 450 (7172): 1036–42. doi:10.1038/nature06418. PMID: 18075584