Acetat de zinc
L'acetat de zinc és el compost químic amb la fórmula de Zn(O₂CCH₃)₂, que habitualment es produeix com dihidrat Zn(O₂CCH₃)₂ · (H₂O)₂. Tant forma hidratada com l'anhidra són sòlids incolors que s'utilitzen normalment en la síntesi química i com suplements dietètics. Els acetats de Zinc són preparats per acció de l'àcid acètic amb el carbonat de zinc o zinc metàl·lic. Quan s'usa com additiu alimentari, té el número I650.
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 181,956 Da |
| Estructura química | |
| Fórmula química | C₄H₆O₄Zn |
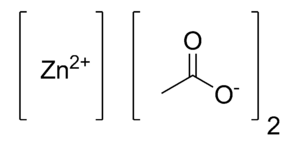 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
Propietats bàsiques i estructura modifica
Igual que pràcticament tots els compostos de zinc, l'acetat de zinc es compon d'ions Zn 2+. El grup acetat és capaç d'unir-se als ions metàl·lics en una varietat de formes a través dels seus dos àtoms d'oxigen i s'observen diversos tipus d'enllaç per als diferents hidrats d'acetat de zinc. L'acetat de zinc anhidre adopta una estructura polimèrica composta de zinc coordinat a quatre àtoms d'oxigen en forma tetraèdrica, on cada tetraedre es connecta als veïns pels grups acetat.[1] Els lligants d'acetat no són bidentats. En canvi, la majoria dels diacetat de metalls disposen al metall en coordinació octaèdrica amb grups acetat bidentats. En l'acetat de zinc dihidrat el zinc és octaèdric, on els dos grups d'acetat són bidentats.[2]
Acetat de zinc bàsic modifica
Escalfar Zn (CH 3 CO 2) 2 en el buit resulta en la pèrdua d'anhídrid acètic, deixant un residu d'acetat de zinc bàsic, amb la fórmula Zn 4 O (CH 3 CO 2) 6. El clúster d'aquest compost té l'estructura tetraèdrica que es mostra a continuació. Aquesta espècie s'assembla molt al compost de berilio corresponent, encara que les distàncies Zn-O són lleugerament més llargues, aproximadament 1.97 vs 1.63 Å per Be 4 O (OAC) 6.[3]
Aplicacions modifica
Aplicacions medicinals i dietàries modifica
L'acetat de zinc s'utilitza com a suplement dietètic i en pastilles utilitzades per tractar el refredat comú. Es creu que l'acetat de zinc només és un tractament més efectiu que el gluconat de zinc.[4] L'acetat de zinc també pot utilitzar per tractar deficiències de zinc. Com un suplement diari per via oral s'utilitza per inhibir l'absorció corporal de coure com a part del tractament per a la malaltia de Wilson. L'acetat de zinc és la millor droga de manteniment per a aquesta malaltia. També es ven com un astringent en forma d'ungüent per combatre la picor, o bé en combinació amb un antibiòtic com l'eritromicina per al tractament tòpic de l'acne.
A la goma de mastegar, l'acetat de zinc és un refrescant de l'alè bucal[5][6] i inhibidor de la placa bacteriana.[7]
Aplicacions industrials modifica
Les aplicacions industrials inclouen conservant de la fusta, la fabricació d'altres sals de zinc o polímers, la fabricació d'acetat d'etilè, com un tint mordent i com a reactiu analític.
L'acetat de zinc és un precursor a través d'un sol-gel dels semiconductors transparents d'òxid de zinc.
Referències modifica
- ↑ Capella, A. V.; Aranda, R. A. "Anhydrous Zinc (II) Acetate (CH 3 -COO) 2 Zn" Crystal Structure Communications 1979, volume 8, 795-797.
- ↑ Van Niekerk, J. N.; Schoening, F. R. L.; Talbot, J. H. "The Crystal Structure of Zinc Acetate Dihydrate, Zn (CH 3 COO) 2 . H 2 O" Acta Crystallographica 1953, volume 6, pages 720-723.
- ↑ Koyama, H.; Saito, I. "The Crystal Structure of Zinc Oxyacetate, Zn 4 O (CH 3 COO) 6 " Bulletin of the Chemical Society of Japan, 1954, volume 27, pages 112-114.
- ↑ Eby GA «Zinc lozenges: cold curi or candy? Solution chemistry determinations». Biosci. Rep, 24, 2004, p. 23-39. DOI: 10.1023/B: BIRE.0000037754.71063.41.
- ↑ Patent-US-7087255
- ↑ Patent-US-6592849
- ↑ Giertsen E, Svatun B, Saxton A «Plaque inhibition by hexetidina and zinc». Scand J Dent Res, 95, 1987, p. 1949-1954.