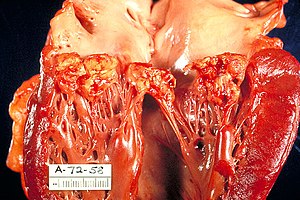
Endocarditis infecciosa
L'endocarditis infecciosa (EI) és una infecció de la superfície interna del cor (l'endocardi) i de les vàlvules.[1] La forma infecciosa és la forma més freqüent d'endocarditis. Els signes i símptomes poden incloure febre, petites àrees d'hemorràgia a la pell, buf cardíac, sensació de cansament i un nombre baix de glòbuls vermells.[1][2] Les complicacions poden incloure el flux sanguini cap enrere al cor, insuficiència cardíaca: el cor lluita per bombar una quantitat suficient de sang per satisfer les necessitats del cos, conducció elèctrica anormal al cor, ictus i insuficiència renal.[1][3][2]
 | |
| Tipus | endocarditis, cardiovascular infection (en) |
|---|---|
| Especialitat | cardiologia i infectologia |
| Clínica-tractament | |
| Símptomes | febre, inflamació, petèquia, Buf cardíac i anèmia |
| Exàmens | transesophageal echocardiography (en) |
| Tractament | antiinfecciós i antiinflamatori |
Medicació vancomicina, nafcillin (en) | |
| Patogènia | |
| Causat per | infecció |
| Classificació | |
| CIM-10 | I33 |
| CIM-9 | 421.0 i 421.1 |
| Recursos externs | |
| MedlinePlus | 000681 |
| UMLS CUI | C0014118 i C1541923 |
| DOID | DOID:0060000 |
La causa sol ser una infecció bacteriana i menys freqüentment una infecció per fongs.[4] Els factors de risc inclouen la malaltia cardíaca valvular, com ara la malaltia reumàtica, la cardiopatia congènita, les vàlvules artificials, l'hemodiàlisi, l'ús de drogues per via intravenosa i els marcapassos electrònics.[4] Els bacteris més afectats són els estreptococs o els estafilococs.[4] El diagnòstic es sospita basant-se en els símptomes i recolzat en hemocultius o ecografia del cor.[4]
La utilitat dels antibiòtics després de procediments dentals per a la prevenció no està clara.[5] Alguns els recomanen per a persones amb alt risc.[4] El tractament és generalment amb antibiòtics intravenosos.[4] L'elecció dels antibiòtics es basa en els resultats dels hemocultius.[4] De vegades es requereix una cirurgia cardíaca.[4]
El nombre de persones afectades és d'uns 5 per 100.000 a l'any.[4] Les taxes, però, varien entre les regions del món.[4] L'endocarditis infecciosa es produeix en homes amb més freqüència que en dones.[4] El risc de mort entre els infectats és d'un 25%.[4] Sense tractament, és gairebé universalment mortal.[4]
Patogènia modifica
De vegades, el seu origen es deriva d'un cateterisme (cardíac o no)[6] o de manipulacions bucodentals sobre una infecció preexistent.[7] En funció del tipus d'intervenció i dels antecedents del pacient, pot estar indicat un tractament profilàctic amb antibiòtics d'ampli especte,[8] ja que els microorganismes potencialment causants d'una endocarditis odontogènica són molts i cada pacient ha de ser valorat rigorosament.[9]
De forma excepcional, persones no immunocompromeses que pateixen una malaltia periodontal poden presentar endocarditis de difícil diagnòstic, sense cap actuació odontològica prèvia i a partir de gèrmens de la flora oral normal, com el bacil Capnocytophaga ochracea.[10] En el cas de Abiotrophia defectiva (un coc Gram-positiu propi de la microbiota bucal),[11] el bacteri pot causar endocarditis refractàries al tractament antibiòtic que arriben a destruir les vàlvules i a crear fístules càrdio-aòrtiques.[12] El bacteri Gram-negatiu Aggregatibacter aphrophilus també és una font atípica d'endocarditis.[13] Aquest microorganisme forma part d'un petit grup de bacteris Gram-negatius anomenat HACEK (Haemophilus spp., Aggregatibacter spp., Cardiobacterium hominis, Eikenella corrodens i Kingella spp.), que tenen en comú unes característiques determinades: colonitzen l'orofaringe, són difícils d'identificar en els cultius sanguinis de rutina i provoquen endocarditis en individus relativament joves, sovint sense signes clínics específics. La infecció per aquests bacteris és l'origen del 3-5% d'endocarditis.[14] Dins del grup, E. corrodens és la font d'EIs més inusual, amb menys de 20 casos registrats en la literatura mèdica.[15] C. hominis té una baixa virulència, però també és un germen causant d'endocarditis molt insidioses que es tracten amb cefaloesporines de tercera generació.[16]
Possibles causes de la malaltia modifica
L'any 2014 es va publicar el primer cas d'EI -comprovat emprant la tècnica de PCR en un malalt amb cultius negatius- causada per Helicobacter cinaedi, una espècie campilobacteral patògena poc freqüent.[17] Els campilobacteris poques vegades provoquen infeccions fora del tracte gastrointestinal; l'espècie Campylobacter fetus, però, s'ha identificat de forma creixent com a causant d'EIs en el decurs dels darrers anys.[18] El coc aeròbic, alfa-hemolític i Gram-positiu, Aerococcus urinae, provoca cistitis i infeccions de vies urinàries altes. És confon fàcilment amb diverses espècies estreptocòciques i estafilocòcciques. Els avenços en les tècniques de tipificació microbiològica[19] fan possible a hores d'ara identificar-lo com un microorganisme causant d'EIs de pronòstic incert, sobretot en pacients ancians amb diferents comorbiditats.[20]
Esporàdicament apareixen casos d'EIs per Tropheryma whipplei, un bacteri de la família dels Actinomyces que és el patogen que provoca la malaltia de Whipple.[21] Tampoc abunden les EIs per Legionel·la spp. (els gèrmens causants de la legionel·losi), que acostumen a ser difícilment detectables i de curs crònic,[22] o per Gemella haemolysans (un coc gram-positiu anaerobi present a les membranes mucoses).[23]
Amb tot, una de les causes d'endocarditis, encara freqüent a molts països avui dia, és la febre reumàtica (FR).[24] Algunes estimacions indiquen que aquesta malaltia és l'origen subjacent de més del 50% de totes les endocarditis.[25] La FR és una seqüela inflamatòria sistèmica de la infecció per l'estreptococ beta-hemolític del grup A, derivada de la reacció immune davant del bacteri generada per individus genèticament predisposats, i que té una alta taxa de recurrències. Si bé la FR afecta a diferents òrgans i teixits, és al cor en què deixa lesions permanents. Les lesions proliferatives cardíaques patognomòniques de la FR són els nòduls d'Aschoff,[26] els quals tenen un nucli de col·lagen necròtic envoltat de cèl·lules reticuloentotelials, plasmòcits i limfòcits. No són reversibles i després de la fase aguda de la FR provoquen fibrosi, calcificacions i focus de deformació que cursen amb insuficiència i estenosi valvular: mitral (85%), aórtica (45%), tricúspide (10%) i pulmonar (2%). Amb el temps, es produeixen més adherències i retraccions irregulars que empitjoren l'estenosi.[27]
Aquestes irregularitats són unes zones fàcilment colonitzables pels microbis i, per això, aquests pacients tendeixen a desenvolupar EIs després d'una bacterièmia, motiu que fa recomanable l'administració de profilaxi antibiòtica en cas de ser sotmesos a determinades intervencions o exploracions.[28] Segons un estudi realitzat a 14 països africans i asiàtics de renda baixa i baixa-mitjana, l'índex d'EIs entre les persones afectes de cardiopatia reumàtica és de 3,65/1000 casos-any.[29] Un altre treball, limitat a malalts del Regne Unit controlats durant 5 anys, mostra un risc de desenvolupar una EI del 30% entre els pacients amb aquest tipus de cardio/valvulopatia preexistent.[30]
Una altra valvulopatia que afavoreix el desenvolupament d'EIs és el prolapse mitral de qualsevol etiologia. S'estima una incidència anyal d'un EI/1100 malalts amb prolapse mitral. Els pacients afectes d'una regurgitació greu són els que tenen un major risc de sofrir una EI.[31] Els microorganismes predominants en aquest tipus d'endocarditis són els estreptococs del grup viridans.[32] El tractament d'elecció en aquest cas és la reparació quirúrgica de la vàlvula.[33]
Algunes formes de la síndrome d'Ehlers-Danlos (una malaltia genètica autosòmica dominant) originen importants anomalies estructurals en les vàlvules cardíaques que incrementen el risc d'aparició d'una endocarditis.[34]
L'EI és una patologia que es veu moltes vegades en drogoaddictes per via endovenosa.[35] Eventualment, també es troben casos a conseqüència de piercings efectuats sense garanties higièniques.[36]
Les cardiopaties congènites són un dels factors que predisposen el desenvolupament d'una endocarditis, la qual acostuma a ser causada per Streptococcus spp. o Staphylococcus spp.[37] Les EIs associades amb aquest grup de cardiopaties s'observen sobretot en casos de vàlvula aòrtica bicúspide i comunicació interauricular, afecten a persones joves que sovint són sotmeses a cirurgia i tenen un pronòstic millor que la resta d'endocarditis.[38]
Danys associats a l'endocarditis infecciosa modifica
Unes lesions associades clàssicament a l'EI (si bé es poden veure en altres malalties), són els nòduls d'Osler.[39] Es presenten com "bonys" subcutanis ben definits i de color vermell-violaci, dolorosos, als palpissos dels dits i/o les eminències tènars o hipotènars. En les endocarditis agudes, es deuen a petites embòlies sèptiques i el cultiu de material obtingut per punció-aspiració pot ser un element diagnòstic del quadre. En les endocarditis cròniques, la causa acostuma a ser una arteritis de la microvasculatura de la pell i el teixit subcutani amb dipòsit focal de complexos immunes. De vegades, la seva patogènia és mixta.[40] Lesions similars poden sorgir a les puntes dels dits del peus.[41] En un ~5% dels casos d'EI apareixen taques de Roth (també anomenades punts de Litten),[42] les quals són hemorràgies retinals localitzades a prop del disc òptic amb un centre blanquinós, formades per cúmuls de fibrina i hematies.[43] Aquestes taques, que moltes vegades són asimptomàtiques, no són exclusives de les EIs i poden observar-se en un ampli ventall d'afeccions sistèmiques. La seva existència, però, és altament suggestiva d'endocarditis subaguda.[44]
Altres signes perifèrics propis de les EIs són les lesions de Janeway (nòduls eritematosos, sense tensió a la seva superfície ni dolor, que surten als palmells de les mans i les plantes dels peus)[45] les hemorràgies "en estella" (petites hemorràgies lineals -uns 2/3 mm de llarg- que es veuen a sota de les ungles)[46] i la presència de petèquies en la conjuntiva palpebral.[47] La majoria dels pacients amb EI presenten episodis febrils, de forma més o menys regular. És una de les patologies a descartar en casos de febre d'origen desconegut, sobretot si l'auscultació detecta un buf cardíac.[48] De vegades, però, la malaltia cursa sense cap augment de la temperatura corporal (endocarditis eutèrmica).[49] De tant en tant, s'han registrat EIs que debuten amb una artritis sèptica monofocal o multifocal, la major part d'elles per S. aureus[50] o Streptococcus viridans.[51] S. viridans és el germen responsable d'entre un 20-24% de les EIs sobre vàlvula nativa en no ADVP.[52]
A banda de les taques de Roth esmentades abans, les EIs tenen altres manifestacions oculars. Predominen les endoftalmitis[53] i les oclusions embòliques de l'artèria retinal o de les seves branques[54] (oclusions que també es poden produir en casos d'endocarditis no bacteriana).[55] Algunes vegades es presenten abscessos a l'iris.[56][57]
El suec Emanuel Winge (1827-1894) fou el primer en determinar la naturalesa microbiològica de l'EI (1869). Els alemanys Theodor Klebs (1834-1913) i Ottomar Rosenbach (1851-1907) confirmaren experimentalment el fet provocant infeccions en vàlvules de conills emprant diferents mètodes entre 1878 i 1881. La malaltia causà la mort del compositor Gustav Mahler i del neuròleg Alois Alzheimer.[58][59]
Diagnòstic modifica
L'ecografia, de tipus transtoràcic o transesofàgic, és la tècnica d'elecció per diagnosticar les endocarditis i les seves troballes són fonamentals per escollir el tipus de tractament a emprar segons les característiques de l'endocarditis. Moltes vegades, la informació que aporten dites exploracions també te valor pronòstic.[60]
Establits l'any 1994 pel servei d'endocarditis de Duke i revisats l'any 2000, els criteris de Duke són una col·lecció de criteris majors i menors utilitzats per establir un diagnòstic d'endocarditis infecciosa:[61][62]
Criteris majors
- Hemocultiu positiu amb microorganisme típic d'EI, definit com un dels següents:[63]
- Dos cultius positius d'aquests microorganismes:
- Estreptococs del grup Viridans, o
- Streptococcus bovis incloent soques variants nutricionals, o
- grup HACEK, o
- Staphylococcus aureus, o
- Enterococs adquirits a la comunitat, en absència d'un focus primari
- Microorganismes en cultius de sang persistentment positius definits com:
- Dos cultius positius de mostres de sang extretes amb més de 12 hores de diferència, o
- Tres o la majoria de ≥quatre hemocultius separats (amb la primera i l'última mostra extretes almenys amb una hora de diferència)
- Coxiella burnetii detectada per almenys un hemocultiu positiu o un títol d'anticossos IgG per a l'antigen de fase 1 de la febre Q > 1:800. Aquest era abans un criteri menor
- Dos cultius positius d'aquests microorganismes:
- L'evidència d'afectació endocàrdica amb ecocardiograma positiu es defineix com
- Massa intracardíaca oscil·lant sobre la vàlvula o les estructures de suport, en el camí dels fluxos regurgitants o sobre el material implantat en absència d'una explicació anatòmica alternativa, o
- Abscés, o
- Nova dehiscència parcial de la vàlvula protèsica o nova insuficiència valvular (un empitjorament o un canvi d'un buf preexistent no són suficients)
Criteris menors:
- Factor predisposant: lesió cardíaca coneguda, injecció de drogues recreatives
- Febre >38 °C
- Fenòmens vasculars: èmbol arterial, infarts pulmonars, lesions de Janeway, hemorràgia conjuntival
- Fenòmens immunològics: glomerulonefritis, nòduls d'Osler, taques de Roth, factor reumatoide
- Evidència microbiològica: hemocultiu positiu (que no compleix un criteri major) o evidència serològica d'infecció amb un organisme consistent amb EI però que no compleix el criteri principal
Valoració:
Un d'aquests criteris patològics:
- Es troben microorganismes en la histologia o el cultiu d'una vegetació cardíaca, una vegetació embolitzada o un abscés intracardiac
- Endocarditis activa
Una d'aquestes combinacions de criteris clínics
- Dos criteris clínics majors
- Un criteri major i tres menors
- Cinc criteris menors
El diagnòstic d'endocarditis infecciosa és possible si es compleix una de les combinacions següents de criteris clínics:
- Un criteri major i un altre menor
- Es compleixen tres criteris menors
Classificació semiològica de les EIs modifica
A efectes més semiològics que diagnòstics, alguns especialistes divideixen les EIs en quatre grans grups:[64]
• EI sobre vàlvula cardíaca nativa en la població general. Representa el 50-60% dels casos i es produeix amb molta freqüència a partir d'una lesió valvular preexistent; com ara prolapse de la vàlvula mitral, vàlvula aòrtica bicúspide o una EI prèvia.[65]
• EI sobre vàlvula cardíaca protèsica. Es presenta en un 10-20% de tots els casos i pot ser precoç o tardana. L'EI sobre válvula protèsica precoç es defineix com aquella derivada d'una colonització bacteriana durant l'acte quirúrgic, independentment del temps transcorregut fins l'aparició dels signes clínics (menys de dos mesos, tot i que de vegades s'observen als sis o dotze mesos). L'EI tardana sobre vàlvula protèsica no té relació amb la cirurgia d'implantació i el seu espectre microbiològic és similar al d'una EI sobre vàlvula nativa. Encara que l'EI apareix per igual en pròtesis biològiques i mecàniques, la patogènia i les manifestacions anatomopatològiques i ecocardiogràfiques són diferents en cadascun dels dos tipus. La infecció de les pròtesis mecàniques, sobretot si la contaminació s'ha produït durant el període perioperatori, afecta fonamentalment a la unió entre l'anell i la sutura quirúrgica, fet que comporta una major incidència de complicacions perianulars. En les biopròtesis, la infecció pot localitzar-se a l'anell i als vels membranosos de la pròtesi, sent més freqüent la presència de vegetacions en aquests i la perforació o trencament dels mateixos.[66]
• EI en addictes a drogues per via parenteral (ADVP).[67] Aproximadament un 30% de les EIs. La forma mixta dreta-esquerra no és rara i no acostuma a existir una patología facilitadora o precipitant de base. Les EIs de repetició en aquest grup de malalts són freqüents[68] i el seu risc de sofrir complicacions postoperatòries en cas d'efectuar cirurgia valvular és alt.[69]
• EI amb hemocultius negatius. El diagnòstic de les EIs es basa principalment en l'ecografia i els hemocultius. Ara bé, segons les nombroses sèries de casos publicades, en un 35-70% d'EIs els hemocultius són negatius. Això pot ser conseqüència de teràpia antibiòtica prèvia, gèrmens atípics o limitacions en la tècnica de cultiu. Aquesta problemàtica justifica que les EIs hemocultiu-negatives siguin considerades una entitat semiològica de característiques singulars i que requereix una estratègia analítica multimodal.[70] També, els resultats ecocardiogràfics negatius (~15% dels casos) poden correspondre a estructures alterades causants de confusió (prolapse, engruiximent valvular, etc.), a fases molt inicials de l'EI o a canvis artefactuals relacionats amb material protèsic. Per això, davant d'una forta sospita d'EI i una ecografia transesofàgica negativa, cal repetir-la una setmana després.[71]
Tractament modifica
El tractament, com és lògic, varia segons la tipologia, els gèrmens implicats i el mecanisme causal de l'endocarditis. La Societat Europea de Cardiologia publica regularment unes pautes terapèutiques i de diagnosi actualitzades d'acord amb els consensos científics sobre la malaltia i els resultats dels estudis clínics realitzats.[72] Una de les recomanacions més significatives és la creació d'unitats especialitzades interdisciplinàries que valorin la malaltia des de criteris amb una major perspectiva.[73] En casos determinats, la cirurgia pot ser una opció vàlida per tractar aquesta malaltia.[74]
La mortalitat per EI és important. Als hospitals, des de la dècada de 1970 es manté entorn al 25%, malgrat la introducció d'antibiòtics d'ampli espectre més eficaços i de noves eines diagnòstiques. Aquest fet pot estar relacionat amb l'envelliment de la població general i, per tant, el conseqüent augment de comorbilitats. En el decurs dels darrers anys, s'ha registrat un nombre creixent d'EIs causades per enterococs, un fenomen preocupant, ja els microorganismes a què s'ha fet referència tenen una gran proclivitat a desenvolupar resistències.[75]
Una complicació greu, encara que poc freqüent, de les EIs és la formació de pseudoaneurismes.[76] Eventualment, la ubicació dels pseudoaneurismes provoca isquèmia miocardíaca.[77] En alguns casos es desenvolupen a l'arrel aòrtica després d'una intervenció de recanvi valvular protèsic, requerint un nou acte quirúrgic.[78] S'ha descrit excepcionalment l'aparició d'un pseudoaneurisma micòtic de l'artèria cubital consegüent a EI mitral per estafilococs.[79]
Tipus de microorganismes que poden originar la malaltia modifica
Bartonella spp. modifica
El gènere bacterià Bartonella origina el 5-30% de tots els casos d'endocarditis, principalment en homes, els quals es caracteritzen per un dany valvular de progrés ràpid que pot acabar en una perforació, sobretot de la vàlvula aòrtica.[80] L'espècie Bartonella quintana, agent etiològic de la 'febre de les trinxeres' transmesa pels polls i molt difícil d'identificar per hemocultiu, provoca endocarditis greus i recurrents -predominantment en persones sense sostre i/o alcohòliques- que tenen un pronòstic molt dolent si el bacteri s'estén pel miocardi.[81][82] Bartonella henselae, espècie causant de la limforeticulosi benigna, pot ocasionar EIs subagudes i de curs insidiós que requereixen un tractament antibiòtic agressiu.[83]
Bacteri Bartonella bovis modifica
Bartonella bovis és un amoïnador patògen de distribució global causant d'endocarditis en el bestiar boví. La incidència d'endocarditis ocasionades pel bacteri varia molt segons les soques presents en una regió geogràfica determinada.[84] Els animals adquireixen B. bovis a través de picades/mossegades d'artròpodes vectors, i són infeccions que sovint donen una simptomatologia pobre, de forma que la major part de les endocarditis es detecten a l'escorxador o en necròpsies veterinàries.[85]
Bacteri Coxiella burnetti modifica
El bacteri Coxiella burnetii, causant de la febre Q, pot originar EIs de curs insidiós i mal pronòstic.[86] Normalment, afecten a persones amb anomalies valvulars preexistents o immunodeprimides. Sovint, aquestes endocarditis són asimptomàtiques i representen un alt risc de cronificació de la malaltia si no són detectades i tractades preventivament.[87] Representen un ~5% de totes les EIs. Ja que C. burnetii no creix en els medis de cultiu habituals, el diagnòstic d'aquesta endocarditis és difícil i requereix positivitat serològica. Fins i tot, la sensibilitat dels estudis amb PCR és només del 75%.[88] El tractament farmacològic d'aquestes EIs consisteix en doxiciclina 100 mg/12 h + rifampicina 300 mg/dia, o bé doxiciclina 100 mg/12 h + hidroxicloroquina 600 mg/dia.[89]
Bacteri Lactococcus lactis modifica
Lactococcus lactis té una baixa virulència i, en general, no es considera un patogen humà. És un microorganisme anaeròbic, catalasa-negatiu i Gram-positiu àmpliament utilitzat en la producció de formatges, iogurts i llet agra (les seves lactases activen la fermentació) i que pot causar infeccions oportunistes. Les EIs lactococcòciques són rares i pocs casos han estat registrats en la literatura mèdica, la majoria en persones que tenen contacte amb bovins, vinculades a la indústria lletera o consumidores de làctics casolans.[90]
Fongs de l'ordre Mucorals modifica
L'endocarditis per mucorals és una raresa. Gairebé sempre apareix en persones immunocompromesses i acostuma a ser funesta.[91] En algun cas, s'ha produït una isquèmia aguda bilateral a les cames a causa d'embolismes fúngics derivats d'una mucormicosi disseminada.[92] Les EIs originades per fongs no són freqüents, però comporten una alta mortalitat (superior al 50% dels malalts) malgrat el tractament antimicòtic.
Fong Candida albicans modifica
Candida spp. (i en particular l'espècie Candida albicans) és el principal gènere responsable de les endocarditis fúngiques,[93] encara que la generalització de les tècniques de diagnosi molecular ha fet possible identificar en elles diverses altres espècies d'aquest tipus de fongs amb gran fiabilitat.[94][95] Les endocarditis per C. albicans es veuen sovint en persones amb mobilitat reduïda o enllitades i que pateixen infeccions respiratòries de repetició tractades amb antibiòtics d'ampli espectre per via endovenosa.[96] Excepcionalment, poden ser conseqüència d'una perforació diverticular intestinal.[97]
Llevats Kodamaea ohmeri, Rhodotorula mucilaginosa i Saccharomyces cerevisiae modifica
El llevat patogen emergent Kodamaea ohmeri s'ha identificat com l'agent causal d'endocarditis nosocomials infantils sobre vàlvules natives.[98] Un altre llevat oportunista que pot provocar EIs en pacients trasplantats és Rhodotorula mucilaginosa.[99] Saccharomyces cerevisiae és una causa infreqüent d'EIs,[100] especialment en subjectes sense problemes immunitaris.[101]
Bacteri Propionibacterium acnes modifica
El bacil Gram-positiu Propionibacterium acnes, propi de la microbiota normal de la pell, pot ser causa d'endocarditis a vàlvules cardíaques protèsiques i d'abscessos concomitants.[102] De forma inusual, P. acnes s'ha identificat com l'agent causal d'EIs sobre vàlvula nativa, sense cap simptomatologia evident. Cal destacar que aquest bacil és un contaminant habitual dels cultius microbiològics, característica que fa possible que el seu creixement en ells sigui sovint motiu de males interpretacions.[103]
Peptostreptococcus spp. modifica
Uns altres cocs anaerobis de la flora microbiana mucocutània, pertanyents al gènere Peptostreptococcus, provoquen endocarditis en vàlvules nadiues i protèsiques amb un alt risc d'embolització pulmonar i sistèmica.[104]
Bacteri Kingella kingae modifica
El cocobacil anaerobi Gram-negatiu Kingella kingae, conegut des de 1960,[105] es considera una font emergent d'endocarditis, incloent-hi els nens sense alteracions estructurals cardíaques.[106] Les EIs per anaerobis són rares, però s'ha descrit algun cas de colonització valvular conjunta per diferents espècies dels anomenats gèrmens.[107]
Bacteri Haematobacter massiliensis modifica
Haematobacter massiliensis, un insidiós bacil aeròbic Gram-negatiu d'un gènere microbiològic tipificat l'any 2007 (Haematobacter),[108] és una de les noves causes d'EI registrades durant els darrers anys.[109][110] Histoplasma capsulatum no sempre es detecta als hemocultius i provoca endocarditis molt greus en persones que viuen a llocs on aquest fong és endèmic.[111] Les zoonosis no acostumen a produir EIs.
Bacteri Capnocytophaga canimorsus modifica
Rarament i en subjectes proclius a les infeccions, Capnocytophaga canimorsus (un bacteri comensal present a la saliva dels gossos i alguns gats) ocasiona endocarditis després d'una mossegada.[112][113] De forma anecdòtica, aquest microorganisme ha estat l'origen d'endocarditis com a conseqüència d'una mossegada de lleó, amb desenllaç fatal.[114]
Bacteri Neissèria sicca modifica
El diplococ Gram-negatiu Neissèria sicca, en aquest cas un comensal del tracte respiratori superior humà, ha estat identificat com a patogen causal d'endocarditis responsables d'embòlies pulmonars bilaterals[115] i infarts cerebrals embòlics múltiples en malalts amb diverses patologies preexistents.[116]
Bacteri Staphylococcus aureus modifica
És una de les causes més comunes d'EIs derivades d'infeccions nosocomials.[117] Aquestes endocarditis tenen una alta mortalitat i són particularment difícils de tractar quan estan produïdes per una soca del bacteri resistent a la meticil·lina.[118]
Bacteri Staphylococcus lugdunensis modifica
Un germen propi de la pell del perineu i de les engonals, el Staphylococcus lugdunensis,[119] origina EIs molt agressives, especialment perilloses en dones embarassades. S'han publicat diversos casos d'EIs provocades per aquest estafilococ subsegüents a la pràctica de vasectomies.[120][121] La incidència general d'EIs en gestants és de 1/100000 embarassos i són causants d'una mortalitat materna (~33%) i fetal (~29%) elevada.[122]
Bacteri Staphylococcus warnerii modifica
Staphylococcus warnerii, un estafilococ coagulasa-negatiu causant d'infeccions intrahospitalàries i bacterièmies postcateterisme, pot ser l'origen d'EIs recurrents que requereixen una antibioticoteràpia complexa.[123] El lactobacil vancomicina-resistent Weissella confusa, pertanyent a la família Leuconostocaceae, provoca endocarditis de mal pronòstic.[124]
Bacteri Streptococcus bovis modifica
S'ha observat al sud d'Europa un augment del nombre d'endocarditis per Streptococcus bovis (en especial del biotip I, anomenat avui dia S. gallolyticus) en vàlvules sense patologia prèvia de pacients predominantment geriàtrics. Aquest coc Gram-negatiu s'associa amb el desenvolupament de bacterièmies en persones afectes d'una neoplàsia colorectal o greus trastorns hepàtics.[125] Aquest increment no ha estat registrat als EUA o a Austràlia i els especialistes creuen que la causa es deu a clonacions esporàdiques, selectives i resistents del coc, originades en la microflora endògena intestinal d'alguns grups de població de la zona.[126] L'aparició en un pacient d'una EI d'aquestes característiques fa recomanable descartar la concurrència de neoformacions a colon.[127]
Bacteri Streptobacillus moniliformis modifica
Aquest bacil, un dels agents causals de la febre per mossegada de rata,[128] provoca EIs greus en persones que tenen contacte amb rosegadors o que ingereixen aigua o aliments contaminats pels excrements d'animals infectats.[129][130]
Enterococcus spp. modifica
El gènere bacterià Enterococcus és la causa d'un ~8% de les endocarditis en vàlvules natives dins de la comunitat, del ~16% de les nosocomials i del 9% de les corresponents a addictes a drogues per via parenteral. Es veu en un 8% d'EIs sobre pròtesi cardíaca durant els primers dos mesos posteriors a la cirurgia, en un 12% entre els 2 i els 12 mesos i en un 11% un any o més després de l'operació. Pot presentar-se amb un quadre inespecífic de febre i poliartritis.[131] E. faecalis és l'espècie que origina EIs amb més freqüència, sobretot en persones amb una neoplàsia colònica subjacent.[132]
Bibliografia modifica
- Habib, Gilbert; Lancellotti, Patrizio; Antunes, Manuel J.; Bongiorni, Maria Grazia; et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM) (en anglès). Eur Heart J, 2015 Nov 21; 36 (44), pp: 3075-3128. PMID: 26320109. DOI 10.1093/eurheartj/ehv319 [Consulta: 20 gener 2020].
- Huckel, Victor F. Infective Endocarditis (en anglès). Merck Manuals. Professional Version, 2016; Jun, pàgs: 19 [Consulta: 28 agost 2017]. Disponible a: https://www.merckmanuals.com/professional/cardiovascular-disorders/endocarditis/infective-endocarditis
- Liesman, Rachael M.; Pritt, Bobbi S.; Maleszewski, Joseph J.; Patel, Robin. Laboratory Diagnosis of Infective Endocarditis (en anglès). J Clin Microbiol, 2017 Set; 55 (9), pp: 2599-2608. PMID: 28659319. DOI 10.1128/JCM.00635-17 [Consulta: 9 desembre 2020].
- Wei, Xue-Biao; Huang, Jie-Leng; Liu, Yuan-Hui; Duan, Chong-Yang; et al. Incidence, Risk Factors and Subsequent Prognostic Impact of New-Onset Atrial Fibrillation in Infective Endocarditis (en anglès). Circ J, 2020 Gen 24; 84 (2), pp: 262-268. PMID: 31839653. DOI 10.1253/circj.CJ-19-0854 [Consulta: 18 maig 2021].
- Limonta, Silvia; Cambau, Emmanuelle; Erpelding, Marie-Line; Piau-Couapel, Caroline; et al. Infective Endocarditis Related to Unusual Microorganisms: A Prospective Population-Based Study (en anglès). Open Forum Infect Dis, 2020 Abr 13; 7 (5), pp: ofaa127. PMID: 32420404. DOI 10.1093/ofid/ofaa127 [Consulta: 20 desembre 2020].
Referències modifica
- ↑ 1,0 1,1 1,2 «Infective Endocarditis – Cardiovascular Disorders» (en anglès canadenc), setembre 2017. [Consulta: 11 desembre 2017].
- ↑ 2,0 2,1 Kumar, Manish; Anstadt, Emily J.; Lopetegui Lia, Nerea; Siddiqi, Misbahul H. «Streptococcus viridans Endocarditis Affecting All Four Valves». Cureus, 11, 5, 10-05-2019, pàg. e4635. DOI: 10.7759/cureus.4635. ISSN: 2168-8184. PMC: 6623990. PMID: 31312561.
- ↑ «Infective Endocarditis in Low- and Middle-Income Countries». Cardiology Clinics, 35, 1, febrer 2017, pàg. 153–163. DOI: 10.1016/j.ccl.2016.08.011. PMID: 27886786.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 4,12 «The Changing Epidemiology of Infective Endocarditis in the Twenty-First Century». Current Infectious Disease Reports, 19, 5, maig 2017, pàg. 21. DOI: 10.1007/s11908-017-0574-9. PMID: 28401448.
- ↑ «Antibiotic prophylaxis for infective endocarditis: a systematic review and meta-analysis». Heart, 103, 12, juny 2017, pàg. 937–944. DOI: 10.1136/heartjnl-2015-309102. PMID: 28213367.
- ↑ Janga KC, Sinha A, Greenberg S, Sharma K «Nephrologists Hate the Dialysis Catheters: A Systemic Review of Dialysis Catheter Associated Infective Endocarditis» (en anglès). Case Rep Nephrol, 2017 Mar; 2017, pp: 9460671. DOI: 10.1155/2017/9460671. PMC: 376949. PMID: 28409042 [Consulta: 8 maig 2017].
- ↑ Chen PC, Tung YC, Wu PW, Wu LS, et al «Dental Procedures and the Risk of Infective Endocarditis» (en anglès). Medicine (Baltimore), 2015 Oct; 94 (43), pp: e1826. DOI: 10.1097/MD.0000000000001826. PMC: 4985400. PMID: 26512586 [Consulta: 8 maig 2017].
- ↑ Castillo F, Castillo JC, Anguita P, Roldán R, et al «¿Se siguen en nuestro medio las recomendaciones de profilaxis de endocarditis infecciosa? Diferencias entre los profesionales sanitarios implicados» (en castellà). Aten Primaria, 2017 Mar; 49 (3), pp: 198-200. DOI: 10.1016/j.aprim.2016.02.009. ISSN: 0212-6567. PMID: 27345764 [Consulta: 2 juliol 2017].
- ↑ Taubert KA, Wilson W «Is endocarditis prophylaxis for dental procedures necessary?» (en anglès). Heart Asia, 2017; 9 (1), pp: 63–67. DOI: 10.1136/heartasia-2016-010810. PMC: 5337686. PMID: 28321267 [Consulta: 28 juliol 2017].
- ↑ Buu-Hoi AY, Joundy S, Acar JF «Endocarditis caused by Capnocytophaga ochracea» (en anglès). J Clin Microbiol, 1988 Maig; 26 (5), pp: 1061-1062. PMC: 266522. PMID: 3384900 [Consulta: 3 juliol 2017].
- ↑ Rojas, P; Castillo, P; Sepúlveda, S «Abiotrophia defectiva» (en castellà). Rev Chil Infectol, 2016 Abr; 33 (2), pp: 189-190. DOI: 10.4067/S0716-10182016000200009. ISSN: 0716-1018 [Consulta: 11 agost 2017].
- ↑ Bhattacharya P, Mohammed A, Mizrahi E «Aorto-right ventricular fistula: a rare complication of Abiotrophia Endocarditis» (en anglès). Oxf Med Case Reports, 2017 Jul 3; 2017 (7), pp: omx035. DOI: 10.1093/omcr/omx035. PMC: 5495012. PMID: 28680649 [Consulta: 11 agost 2017].
- ↑ Broa AL, Cruz I, Cotrim C, Diogo J «Aggregatibacter aphrophilus aortic valve infective endocarditis» (en anglès). Infectio, 2017; 21 (2), pp: 126-128. DOI: 10.22354/in.v21i2.656. ISSN: 0123-9392 [Consulta: 19 setembre 2017].
- ↑ Chambers ST, Murdoch D, Morris A, Holland D, et al «HACEK Infective Endocarditis: Characteristics and Outcomes from a Large, Multi-National Cohort» (en anglès). PLoS One, 2013 Maig 17; 8 (5), pp: e63181. DOI: 10.1371/journal.pone.0063181. PMC: 3656887. PMID: 23690995 [Consulta: 19 gener 2018].
- ↑ Nordholm AC, Vøgg ROB, Permin H, Katzenstein T «Eikenella corrodens endocarditis and liver abscess in a previously healthy male, a case report» (en anglès). BMC Infect Dis, 2018 Gen 12; 18 (1), pp: 35. DOI: 10.1186/s12879-018-2949-4. ISSN: 1471-2334. PMID: 29329519 [Consulta: 19 gener 2018].
- ↑ Arunachalam, K «Atypical presentation of infective endocarditis» (en anglès). R I Med J (2013), 2016 Jul 1; 99 (7), pp: 24-26. ISSN: 2327-2228. PMID: 27379355 [Consulta: 1r maig 2018].
- ↑ Bartels H, Goldenberger D, Reuthebuch O, Vosbeck J, et al «First case of infective endocarditis caused by Helicobacter cinaedi» (en anglès). BMC Infect Dis, 2014 Nov 18; 14, pp: 586. DOI: 10.1186/s12879-014-0586-0. PMC: 4243372. PMID: 25403102 [Consulta: 6 octubre 2017].
- ↑ Désidéri-Vaillant, Catherine; Guichon, Jean-Michel; Noyer, Vincent; Nedelec, Yolande; Galinat, Hubert «Campylobacter fetus endocarditis: a case report». Annales de biologie clinique, 71, 4, 2013-07, pàg. 465–467. DOI: 10.1684/abc.2013.0862. ISSN: 0003-3898.
- ↑ Rasmussen, M «Aerococcus: an increasingly acknowledged human pathogen» (en anglès). Clin Microbiol Infect, 2016 Gen; 22 (1), pp: 22-27. DOI: 10.1016/j.cmi.2015.09.026. ISSN: 1469-0691. PMID: 26454061 [Consulta: 7 febrer 2018].
- ↑ Tathireddy H, Settypalli S, Farrell JJ «A rare case of aerococcus urinae infective endocarditis» (en anglès). J Community Hosp Intern Med Perspect, 2017 Jun 6; 7 (2), pp: 126-129. DOI: 10.1080/20009666.2017.1314072. PMC: 5473194. PMID: 28638578 [Consulta: 7 febrer 2018].
- ↑ García-Álvarez L, Sanz MM, Marín M, Fariñas M, et al «Tropheryma whipplei endocarditis in Spain: Case reports of 17 prospective cases» (en anglès). Medicine (Baltimore), 2016 Jun; 95 (26), pp: e4058. DOI: 10.1097/MD.0000000000004058. PMC: 4937956. PMID: 27368042 [Consulta: 1r maig 2018].
- ↑ Compain F, Bruneval P, Jarraud S, Perrot S, et al «Chronic endocarditis due to Legionella anisa: a first case difficult to diagnose» (en anglès). New Microbes New Infect, 2015 Oct 22; 8, pp: 113-115. DOI: 10.1016/j.nmni.2015.10.003. PMC: 4652024. PMID: 26693025 [Consulta: 27 maig 2018].
- ↑ Agrawal T, Irani M, Fuentes Rojas S, Jeroudi O, Janjua E «A Rare Case of Infective Endocarditis Caused by Gemella haemolysans» (en anglès). Cureus, 2019 Nov 26; 11 (11), pp: e6234. DOI: 10.7759/cureus.6234. PMC: 6935327. PMID: 31890433 [Consulta: 12 gener 2020].
- ↑ Goodwin, JF «Natural history and management of chronic rheumatic endocarditis» (en anglès). Bristol Med Chir J, 1969 Oct; 84 (312), pp: 107-114. PMC: 5068103. PMID: 5824913 [Consulta: 8 maig 2017].
- ↑ Seckeler MD, Hoke TR «The worldwide epidemiology of acute rheumatic fever and rheumatic heart disease» (en anglès). Clin Epidemiol, 2011 Feb 22; 3, pp: 67–84. DOI: 10.2147/CLEP.S12977. PMC: 3046187. PMID: 21386976 [Consulta: 7 febrer 2018].
- ↑ Chopra, P «Origin of Aschoff nodule. An ultrastructural, light microscopic and histochemical evaluation» (en anglès). Jpn Heart J, 1985 Mar; 26 (2), pp: 227-234. ISSN 1348-673X. DOI: 10.1536/ihj.26.227. PMID: 4009966 [Consulta: 12 gener 2020].
- ↑ Ros-Viladoms, JB «Fiebre reumática. Enfermedad emergente» (en castellà). An Pediatr Contin, 2010 Gen 1; 8 (1), pp: 17-25. ISSN 1696-2818. DOI: 10.1016/S1696-2818(10)70003-2. ISSN: 1696-2818 [Consulta: 19 març 2018].
- ↑ Tulunay Kaya, C; Erol, C «How to achieve infective endocarditis prophylaxis» (en anglès). e-Journal of Cardiology Practice, ESC, 2018 Des 12; 16 (33), pp:. ISSN: 1234-5678 [Consulta: 9 maig 2021].
- ↑ Zühlke L, Karthikeyan G, Engel ME, Rangarajan S, et al «Clinical Outcomes in 3343 Children and Adults With Rheumatic Heart Disease From 14 Low- and Middle-Income Countries: Two-Year Follow-Up of the Global Rheumatic Heart Disease Registry (the REMEDY Study)» (en anglès). Circulation, 2016 Nov 8; 134 (19), pp: 1456-1466. DOI: 10.1161/CIRCULATIONAHA.116.024769. ISSN: 1524-4539. PMID: 27702773 [Consulta: 19 març 2018].
- ↑ Thornhill MH1, Jones S, Prendergast B, Baddour LM, et al «Quantifying infective endocarditis risk in patients with predisposing cardiac conditions» (en anglès). Eur Heart J, 2018 Feb 14; 39 (7), pp: 586-595. DOI: 10.1093/eurheartj/ehx655. ISSN: 1522-9645. PMID: 29161405 [Consulta: 19 març 2018].
- ↑ Katan O, Michelena HI, Avierinos JF, Mahoney DW, et al «Incidence and Predictors of Infective Endocarditis in Mitral Valve Prolapse: A Population-Based Study» (en anglès). Mayo Clin Proc, 2016 Mar; 91 (3), pp: 336-442. DOI: 10.1016/j.mayocp.2015.12.006. PMC: 4998970. PMID: 26856780 [Consulta: 18 maig 2018].
- ↑ DeSimone DC, DeSimone CV, Tleyjeh IM, Correa de Sa DD, et al «Association of Mitral Valve Prolapse With Infective Endocarditis Due to Viridans Group Streptococci» (en anglès). Clin Infect Dis, 2015 Ag 15; 61 (4), pp: 623-625. DOI: 10.1093/cid/civ375. PMC: 4542600. PMID: 25963288 [Consulta: 18 maig 2018].
- ↑ Stougiannos PN, Mytas DZ, Kosma LK, Pappas LK, et al «Successful surgical repair of mitral valve prolapse endocarditis: a case report and review of the current literature» (en anglès). Hellenic J Cardiol, 2011 Mar-Abr; 52 (2), pp: 177-181. ISSN: 2241-5955. PMID: 21478131 [Consulta: 18 maig 2018].
- ↑ Jiao Y, Rasnake MS, McCormack MT, Turner JF «Ehlers-Danlos syndrome with infective endocarditis: A case report with literature review» (en anglès). IDCases, 2018 Des 29; 15, pp: e00484. DOI: 10.1016/j.idcr.2018.e00484. PMC: 6322054. PMID: 30627513 [Consulta: 25 gener 2019].
- ↑ Wurcel AG, Anderson JE, Chui KK, Skinner S, et al «Increasing Infectious Endocarditis Admissions Among Young People Who Inject Drugs» (en anglès). Open Forum Infect Dis, 2016 Jul 26; 3 (3), pp: ofw157. DOI: 10.1093/ofid/ofw157. PMC: 5084714. PMID: 27800528 [Consulta: 20 juny 2017].
- ↑ Mariano A, Pisapia R, Abdeddaim A, Taibi C, et al «Endocarditis and meningitis associated to nape piercing in a young female: a case report» (en anglès). Infez Med, 2015 Set; 23 (3), pp: 275-279. ISSN: 1124-9390. PMID: 26397300 [Consulta: 20 juny 2017].
- ↑ Fortún J, Centella T, Martín-Dávila P, Lamas MJ, et al «Infective endocarditis in congenital heart disease: a frequent community-acquired complication» (en anglès). Infection, 2013 Feb; 41 (1), pp: 167-174. DOI: 10.1007/s15010-012-0326-6. ISSN: 1439-0973. PMID: 22956474 [Consulta: 2 juliol 2017].
- ↑ Varvaro Pardo, G; López Díaz, J; Revilla Orodea, A; Ortiz Bautista, C; et al «Endocarditis infecciosa en las cardiopatías congénitas: descripción de sus principales características en una cohorte desde 1997 a 2013» (en castellà). Rev Esp Cardiol, 2013 Oct; 66 (Supl 1). Congreso Enfermedades Cardiovasculares/SEC, Comunicación 4028-5, pp: 245. ISSN: 0300-8932 [Consulta: 15 desembre 2017].
- ↑ Zang, G; Cadogan, M «Osler node» (en anglès). LITFL Medical Eponym Dictionary, 2021; Gen 1, pàgs: 2 [Consulta: 9 maig 2021].
- ↑ Espinosa Parra, FJ; Ramos Rincón, JM; Herrero Huerta, F; et al «Utilidad diagnóstica de los nódulos de Osler en la endocarditis infecciosa en usuarios de drogas por vía parenteral (UDVP)» (en castellà). An Med Interna (Madrid), 2002 Jun; 19 (6), pp: 299-301. ISSN: 0212-7199 [Consulta: 6 juliol 2017].
- ↑ Gomes RT, Tiberto LR, Bello VN, Lima MA, et al «Dermatologic manifestations of infective endocarditis» (en anglès). An Bras Dermatol, 2016 Sep-Oct; 91 (5 Supl 1), pp: 92–94. DOI: 10.1590/abd1806-4841.20164718. PMC: 5325006. PMID: 28300907 [Consulta: 9 juliol 2017].
- ↑ Zang, G «Roth spots» (en anglès). LITFL Medical Eponym Dictionary, 2020; Nov 3, pàgs: 1 [Consulta: 9 maig 2021].
- ↑ Mahroo OA, Graham EM «Images in clinical medicine. Roth spots in infective endocarditis» (en anglès). N Engl J Med, 2014 Jun 19; 370 (25), pp: e38. DOI: 10.1056/NEJMicm1312093. ISSN: 1533-4406. PMID: 24941198 [Consulta: 6 juliol 2017].
- ↑ Ruddy SM, Tivakaran VS «Roth Spots» (en anglès). StatPearls [Internet]. StatPearls Publishing LLC, 2018 Feb 15; NBK482446, pàgs: 4. PMID: 29494053 [Consulta: 19 març 2018].
- ↑ Zang, G «Janeway lesions» (en anglès). LITFL Medical Eponym Dictionary, 2021; Gen 1, pàgs: 2 [Consulta: 9 maig 2021].
- ↑ Smith, Y; Khetrapal, A «Splinter Hemorrhages» (en anglès). News-Medical.Net, 2019; Feb 27 (rev), pàgs: 6 [Consulta: 9 maig 2021].
- ↑ Kubota, H; Kawasaki, T; Kawamata, H; Yamano, M, et al «Peripheral Signs of Infective Endocarditis» (en anglès). Circ J, 2019 Mar 25; 83 (4), pp: 841. DOI: 10.1253/circj.CJ-18-0854. ISSN: 1347-4820. PMID: 30224589 [Consulta: 9 maig 2021].
- ↑ Bush, LM «Fiebre de etiología desconocida» (en castellà). Manual MSD (Versión para profesionales) Merck Sharp & Dohme Corp., 2018; Oct (rev), pàgs: 7 [Consulta: 8 desembre 2017].
- ↑ DeSimone DC, Baddour LM, Lahr BD, Chung HH, et al «Euthermic Endocarditis» (en anglès). PLoS One, 2013 Nov 11; 8(11), pp: e80144. DOI: 10.1371/journal.pone.0080144. PMC: 3823819. PMID: 24244630 [Consulta: 19 juliol 2017].
- ↑ Martínez Oviedo, A; Gracia Sánchez, P; Pueo, E; Chopo, JM «Artritis séptica como manifestación inicial de endocarditis bacteriana por Staphylococcus aureus» (en castellà). An Med Interna, 2006 Abr; 23 (4), pp: 184-186. ISSN 0212-7199. DOI: 10.4321/s0212-71992006000400010. PMID: 16796414 [Consulta: 13 maig 2021].
- ↑ Soor P, Sharma N, Rao C «Multifocal Septic Arthritis Secondary to Infective Endocarditis: A Rare Case Report» (en anglès). J Orthop Case Rep, 2017 Gen-Feb; 7 (1), pp: 65-68. DOI: 10.13107/jocr.2250-0685.692. PMC: 5458702. PMID: 28630844 [Consulta: 6 octubre 2017].
- ↑ Castillo JC, Anguita MP, Ruiz M, Peña L, et al «Cambios epidemiológicos de la endocarditis infecciosa sobre válvula nativa» (en castellà). Rev Esp Cardiol, 2011 Jul; 64 (7), pp: 594-598. DOI: 10.1016/j.recesp.2011.03.011. ISSN: 1579-2242. PMID: 21641100 [Consulta: 18 maig 2018].
- ↑ Sim, YK; Lee, YJ; Park, SW; Kim, JH; et al «Infective Endocarditis Presenting as Endogenous Endophthalmitis Secondary to Streptococcus agalactiae in a Healthy Adult: Case Reports and Literature Review» (en anglès). Infect Chemother, 2017 Des; 49 (4), pp: 286-292. DOI: 10.3947/ic.2017.49.4.286. PMC: 5754340. PMID: 29299896 [Consulta: 10 desembre 2020].
- ↑ Lo, KJ; Lin, YC; Li, HY; Chou, YB «Delayed branch retinal artery occlusion in infectious endocarditis» (en anglès). J Formos Med Assoc, 2020 Jul; 119 (7), pp: 1232-1233. ISSN 0929-6646. DOI: 10.1016/j.jfma.2019.10.015. PMID: 31685405 [Consulta: 20 desembre 2020].
- ↑ Wathek, C; Rannen, R «Ocular Manifestations of Endocarditis» (en anglès). A: Contemporary Challenges in Endocarditis. Chap. 5 (Firstenberg, MS; Ed.) InTech, 2016; Nov 9, pàgs: 8. ISBN 978-953-51-2769-7. DOI: 10.5772/65313 [Consulta: 19 febrer 2018].
- ↑ Chen X, Baumal CR «Iris Abscess» (en anglès). N Engl J Med, 2018 Gen 11; 378 (2), pp: e3. DOI: 10.1056/NEJMicm1705033. ISSN: 1533-4406. PMID: 29320659 [Consulta: 19 febrer 2018].
- ↑ Manrique Lipa R, González Sánchez E, Asencio Duran M, Gonzalez-Peramato P, Fonseca Santodomingo A «Absceso iridiano tras endocarditis bacteriana en un paciente con leucemia. Diagnóstico diferencial» (en castellà). Arch Soc Esp Oftalmol, 2014 Abr; 89 (4), pp: 143-145. DOI: 10.1016/j.oftal.2012.09.011. ISSN: 1989-7286. PMID: 24269469 [Consulta: 19 febrer 2018].
- ↑ Contrepois, A «Towards a history of infective endocarditis» (en anglès). Med Hist, 1996 Gen; 40 (1), pp: 25-54. DOI: 10.1017/s0025727300060658. PMC: 1037058. PMID: 8824676 [Consulta: 13 agost 2017].
- ↑ Geller, SA «Infective endocarditis: a history of the development of its understanding» (en anglès). Autops Case Rep, 2013 Oct-Des; 3 (4), pp: 5–12. DOI: 10.4322/acr.2013.033. PMC: 5453655. PMID: 28584801 [Consulta: 13 agost 2017].
- ↑ Vilacosta I, Olmos C, de Agustín A, López J, et al «The diagnostic ability of echocardiography for infective endocarditis and its associated complications» (en anglès). Expert Rev Cardiovasc Ther, 2015 Nov; 13 (11), pp: 1225-1236. DOI: 10.1586/14779072.2015.1096780. ISSN: 1477-9072. PMID: 26471429 [Consulta: 24 juny 2017].
- ↑ «New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Duke Endocarditis Service». The American Journal of Medicine, 96, 3, març 1994, pàg. 200–9. DOI: 10.1016/0002-9343(94)90143-0. PMID: 8154507.
- ↑ «Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis». Clinical Infectious Diseases, 30, 4, abril 2000, pàg. 633–8. DOI: 10.1086/313753. PMID: 10770721.
- ↑ «Clinical practice. Infective endocarditis». The New England Journal of Medicine, 368, 15, abril 2013, pàg. 1425–33. DOI: 10.1056/NEJMcp1206782. PMID: 23574121.
- ↑ Lozano Sanz, O; Oteiza Lopez, L «Endocarditis infecciosa. A: Libro electrónico de Temas de Urgencia, 12. Enfermedades infecciosas ISBN 978-84-690-6958-5» (en castellà). Servicio Navarro de Salud, 2008; Gen, pàgs: 4 [Consulta: 8 setembre 2017].
- ↑ Büchi A, Hoffmann M, Zbinden S, Atkinson A, Sendi P, et al «The Duke minor criterion "predisposing heart condition" in native valve infective endocarditis - a systematic review» (en anglès). Swiss Med Wkly, 2018 Nov 15; 148, pp: w14675. DOI: 10.4414/smw.2018.14675. ISSN: 1424-3997. PMID: 30440064 [Consulta: 24 novembre 2019].
- ↑ Olmos, C; Vilacosta, I; López, J; Sarriá, C; et al «Actualización en endocarditis protésica» (en castellà). Cir Cardiov, 2017 Gen-Feb; 24 (1), pp: 33-40. DOI: 10.1016/j.circv.2016.11.001. ISSN: 1134-0096 [Consulta: 21 novembre 2017].
- ↑ Miró, JM; Moreno, A; Mestres, CA «Infective Endocarditis in Intravenous Drug Abusers» (en anglès). Curr Infect Dis Rep, 2003 Ag; 5 (4), pp: 307-316. DOI: 10.1007/s11908-003-0007-9. ISSN: 1523-3847. PMID: 12866981 [Consulta: 24 maig 2021].
- ↑ Huang G, Barnes EW, Peacock JE Jr «Repeat Infective Endocarditis in Persons Who Inject Drugs: "Take Another Little Piece of my Heart"» (en anglès). Open Forum Infect Dis, 2018 Nov 16; 5 (12), pp: ofy304. DOI: 10.1093/ofid/ofy304. PMC: 6288769. PMID: 30555849 [Consulta: 24 gener 2019].
- ↑ Lemaire A, Dombrovskiy V, Saadat S, Batsides G, et al «Patients with Infectious Endocarditis and Drug Dependence Have Worse Clinical Outcomes after Valvular Surgery» (en anglès). Surg Infect (Larchmt), 2017 Abr; 18 (3), pp: 299-302. DOI: 10.1089/sur.2016.029. ISSN: 1096-2964. PMID: 28099093 [Consulta: 27 gener 2019].
- ↑ Fournier PE, Gouriet F, Casalta JP, Lepidi H, et al «Blood culture-negative endocarditis: Improving the diagnostic yield using new diagnostic tools» (en anglès). Medicine (Baltimore), 2017 Nov; 96 (47), pp: e8392. DOI: 10.1097/MD.0000000000008392. PMC: 5708915. PMID: 29381916 [Consulta: 27 gener 2019].
- ↑ Baddour LM, Wilson WR, Bayer AS, Fowler VG Jr, et al «Infective Endocarditis in Adults: Diagnosis, Antimicrobial Therapy, and Management of Complications: A Scientific Statement for Healthcare Professionals From the American Heart Association» (en anglès). Circulation, 2015 Oct 13; 132 (15), pp: 1435-1486. DOI: 10.1161/CIR.0000000000000296. ISSN: 1524-4539. PMID: 26373316 [Consulta: 21 maig 2017].
- ↑ Habib G, Erba PA, Iung B, Donal E,et al «Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: a prospective cohort study» (en anglès). Eur Heart J, 2019 Oct 14; 40 (39), pp: 3222-3232. ISSN 1522-9645. DOI: 10.1093/eurheartj/ehz620. PMID: 31504413 [Consulta: 20 gener 2020].
- ↑ Grupo de Trabajo de la SEC y revisores expertos para la guía ESC 2015 sobre endocarditis infecciosa y Comité de Guías de la SEC «Comentarios a la guía ESC 2015 sobre el tratamiento de la endocarditis infecciosa» (en castellà). Rev Esp Cardiol, 2016; 69 (1), pp: 7-10. ISSN 0300-8932. DOI: 10.1016/j.recesp.2015.12.001 [Consulta: 25 juny 2017].
- ↑ Bach, DS «Timing of Surgery in Infective Endocarditis» (en anglès). Latest In Cardiology. American College of Cardiology Foundation, 2016; Gen 8, pàgs: 3 [Consulta: 8 maig 2017].
- ↑ Muñoz P, Kestler M, De Alarcon A, Miro JM, et al «Current Epidemiology and Outcome of Infective Endocarditis: A Multicenter, Prospective, Cohort Study» (en anglès). Medicine (Baltimore), 2015 Oct; 94 (43), pp: e1816. DOI: 10.1097/MD.0000000000001816. PMC: 4985396. PMID: 26512582 [Consulta: 18 febrer 2018].
- ↑ Ojeda-Burgos, G; Ivanova, R; Sánchez Espín, GM; García, MV; et al «Características de los pseudoaneurismas como complicación de la endocarditis infecciosa» (en castellà). Cir Cardiov, 2018 Gen-Feb; 25 (1), pp: 70-71. DOI: 10.1016/j.circv.2017.12.035. ISSN: 1134-0096 [Consulta: 9 abril 2018].
- ↑ Lacalzada-Almeida J, De la Rosa-Hernández A, Izquierdo-Gómez MM, García-Niebla J, et al «Compression of the right coronary artery by an aortic pseudoaneurysm after infective endocarditis: an unusual case of myocardial ischemia» (en anglès). Clin Interv Aging, 2017 Des 21; 13, pp: 9-11. DOI: 10.2147/CIA.S144840. PMC: 5743124. PMID: 29317805 [Consulta: 9 abril 2018].
- ↑ Pelicano NJ, Branco LM, Agapito AF, Salomão S, et al «Infective endocarditis complicated by large aortic pseudoaneurysm after cardiac surgery» (en anglès). Eur J Echocardiogr, 2006 Oct; 7 (5), pp: 394-397. DOI: 10.1016/j.euje.2005.07.006. ISSN: 1532-2114. PMID: 16427363 [Consulta: 9 abril 2018].
- ↑ Polytarchou K, Kratimenos T, Varvarousis D, Tsamatsoulis M, et al «Ulnar pseudoaneurysm complicating infective endocarditis. The role of endovascular stenting» (en anglès). Hellenic J Cardiol, 2017; Nov 21, pii: S1109-9666(17)30484-0. DOI: 10.1016/j.hjc.2017.11.007. ISSN: 2241-5955. PMID: 29169985 [Consulta: 9 abril 2018].
- ↑ Burzo ML, Antonelli M, Pecorini G, Favuzzi AMR, et al «Fever of unknown origin and splenomegaly: A case report of blood culture negative endocarditis» (en anglès). Medicine (Baltimore), 2017 Des; 96 (50), pp: e9197. DOI: 10.1097/MD.0000000000009197. PMC: 5815747. PMID: 29390335 [Consulta: 4 març 2018].
- ↑ Montcriol A, Benard F, Fenollar F, Ribeiri A, et al «Fatal myocarditis-associated Bartonella quintana endocarditis: a case report» (en anglès). J Med Case Rep, 2009 Jul 17; 3, pp: 7325. DOI: 10.4076/1752-1947-3-7325. PMC: 2737767. PMID: 19830188 [Consulta: 27 juliol 2017].
- ↑ Ghidey FY, Igbinosa O, Mills K, Lai L, et al «Case series of Bartonella quintana blood culture-negative endocarditis in Washington, DC» (en anglès). JMM Case Rep, 2016 Ag 30; 3 (4), pp: e005049. DOI: 10.1099/jmmcr.0.005049. PMC: 5330240. PMID: 28348772 [Consulta: 24 gener 2019].
- ↑ Florin TA, Zaoutis TE, Zaoutis LB «Beyond Cat Scratch Disease: Widening Spectrum of Bartonella henselae Infection» (en anglès). Pediatrics, 2008 Maig; 121 (5), pp: e1413-e1425. ISSN 0031-4005. DOI: 10.1542/peds.2007-1897. PMID: 18443019 [Consulta: 4 març 2018].
- ↑ Bai Y, Malania L, Alvarez Castillo D, Moran D, et al «Global distribution of Bartonella infections in domestic bovine and characterization of Bartonella bovis strains using multi-locus sequence typing» (en anglès). PLoS One, 2013 Nov 21; 8 (11), pp: e80894. DOI: 10.1371/journal.pone.0080894. PMC: 3836770. PMID: 24278342 [Consulta: 16 març 2018].
- ↑ Maillard R, Petit E, Chomel B, Lacroux C, et al «Endocarditis in Cattle Caused by Bartonella bovis» (en anglès). Emerg Infect Dis, 2007 Set; 13 (9), pp: 1383-1385. DOI: 10.3201/eid1309.070236. PMC: 2857289. PMID: 18252116 [Consulta: 16 març 2018].
- ↑ Betancur, CA, Munera, AG «Endocarditis por Coxiella burnetii: fiebre Q» (en castellà). Acta Med Colomb, 2012 Gen-Mar; 37 (1), pp: 31-33. ISSN 0120-2448 [Consulta: 13 maig 2021].
- ↑ Fenollar F, Fournier PE, Carrieri MP, Habib G, et al «Risks factors and prevention of Q fever endocarditis» (en anglès). Clin Infect Dis, 2001 Ag 1; 33 (3), pp: 312-316. DOI: 10.1086/321889. PMID: 11438895 [Consulta: 21 maig 2017].
- ↑ Deyell MW, Chiu B, Ross DB, Alvarez N «Q fever endocarditis: A case report and review of the literature» (en anglès). Can J Cardiol, 2006 Jul; 22 (9), pp: 781–785. DOI: 10.1016/s0828-282x(06)70295-1. PMC: 2560519. PMID: 16835673 [Consulta: 14 agost 2017].
- ↑ Roca, B «Fiebre Q» (en castellà). An Med Interna, 2007 Nov; 24 (11), pp: 558-560. DOI: 10.4321/s0212-71992007001100011. ISSN: 0212-7199. PMID: 18275268 [Consulta: 26 novembre 2018].
- ↑ Georgountzos G, Michopoulos C, Grivokostopoulos C, Kolosaka M, et al «Infective Endocarditis in a Young Adult due to Lactococcus lactis: A Case Report and Review of the Literature» (en anglès). Case Rep Med, 2018 Mar 4; 2018, pp: 5091456. DOI: 10.1155/2018/5091456. PMC: 5857332. PMID: 29686711 [Consulta: 1r maig 2018].
- ↑ Metallidis S, Chrysanthidis T, Kazakos E, Saraf A, Nikolaidis P «A fatal case of pacemaker lead endocarditis caused by Mucor spp.» (en anglès). Int J Infect Dis, 2008 Nov; 12 (6), pp: e151-152. DOI: 10.1016/j.ijid.2008.03.034. ISSN: 1878-3511. PMID: 18620884 [Consulta: 7 agost 2017].
- ↑ Tachamo N, Rajagopalan P, Nazir S, Lohani S, et al «Acute ischemia of bilateral lower extremities as a presenting feature of disseminated mucormycosis endocarditis: A case report» (en anglès). J Community Hosp Intern Med Perspect, 2016 Des 15; 6 (6), pp: 33215. DOI: 10.3402/jchimp.v6.33215. PMC: 5161785. PMID: 27987284 [Consulta: 7 agost 2017].
- ↑ Baddley JW, Benjamin DK Jr, Patel M, Miró J, et al «Candida Infective Endocarditis» (en anglès). Eur J Clin Microbiol Infect Dis, 2008 Jul; 27 (7), pp: 519–529. DOI: 10.1007/s10096-008-0466-x. PMC: 2757733. PMID: 18283504 [Consulta: 26 febrer 2018].
- ↑ Lefort, A; Chartier, L; Sendid, B; Wolff, M; et al «Diagnosis, management and outcome of Candida endocarditis» (en anglès). Clin Microbiol Infect, 2012 Abr; 18 (4), pp: E99-E109. DOI: 10.1111/j.1469-0691.2012.03764.x. ISSN: 1198-743X. PMID: 22329526 [Consulta: 20 desembre 2020].
- ↑ Mamtani, S; Aljanabi, NM; Gupta Rauniyar, RP; Acharya, A; Malik, BH «Candida Endocarditis: A Review of the Pathogenesis, Morphology, Risk Factors, and Management of an Emerging and Serious Condition» (en anglès). Cureus, 2020 Gen 18; 12 (1), pp: e6695. DOI: 10.7759/cureus.6695. PMC: 7026878. PMID: 32104631 [Consulta: 20 desembre 2020].
- ↑ Guerriero M, Colasurdo F, Pollio AM «Huge Candida albicans normal native tricuspid valve endocarditis» (en anglès). Autops Case Rep, 2018 Abr 18; 8 (2), pp: e2018021. DOI: 10.4322/acr.2018.021. PMC: 5953187. PMID: 29780757 [Consulta: 26 maig 2018].
- ↑ Farooqui, AM; Hart, E; Nzewi, O «Rare case of Fungal Endocarditis secondary to a perforated diverticulum» (en anglès). Journal of Cardiothoracic Surgery, 2015 Des 16; 10 (Supl 1), pp: A31. DOI: 10.1186/1749-8090-10-S1-A31. ISSN: 1749-8090 [Consulta: 26 febrer 2018].
- ↑ Sundaram PS, Bijulal S, Tharakan JA, Antony M «Kodamaea ohmeri tricuspid valve endocarditis with right ventricular inflow obstruction in a neonate with structurally normal heart» (en anglès). Ann Pediatr Cardiol, 2011 Gen-Jun; 4 (1), pp: 77–80. DOI: 10.4103/0974-2069.79632. PMC: 3104542. PMID: 21677814 [Consulta: 12 abril 2018].
- ↑ Cabral AM, da Siveira Rioja S, Brito-Santos F, Peres da Silva JR, et al «Endocarditis due to Rhodotorula mucilaginosa in a kidney transplanted patient: case report and review of medical literature» (en anglès). JMM Case Rep, 2017 Nov 2; 4 (11), pp: e005119. DOI: 10.1099/jmmcr.0.005119. PMC: 5729897. PMID: 29255609 [Consulta: 27 maig 2018].
- ↑ Ruiz-Esquide, F; Díaz, MC; Wu, E; Silva, V «Endocarditis verrucosa secundaria a Saccharomyces cerevisiae. Caso clínico» (en castellà). Rev Méd Chile, 2002 Oct; 130 (10), pp: 1165-1169. ISSN 0034-9887. DOI: 10.4067/S0034-98872002001000012 [Consulta: 24 maig 2021].
- ↑ Hammond, R; Aggarwal, D; Hurt, W; Ferran, E; et al «Brewer’s Yeast as a cause of infective endocarditis» (en anglès). Access Microbiol, 2020 Feb; 2 (2), págs: 1. ISSN 2516-8290. DOI: 10.1099/acmi.fis2019.po0037 [Consulta: 24 maig 2021].
- ↑ Kurz M, Kaufmann BA, Baddour LM, Widmer AF «Propionibacterium acnes prosthetic valve endocarditis with abscess formation: a case report» (en anglès). BMC Infect Dis, 2014 Feb 25; 14, pp: 105. DOI: 10.1186/1471-2334-14-105. PMC: 4015906. PMID: 24568204 [Consulta: 7 agost 2017].
- ↑ Yamamoto R, Miyagawa S, Hagiya H, Kimura K, et al «Silent Native-valve Endocarditis Caused by Propionibacterium acnes» (en anglès). Intern Med, 2018; Mar 30, pp: 1-4. DOI: 10.2169/internalmedicine.9833-17. ISSN: 1349-7235. PMID: 29607974 [Consulta: 15 abril 2018].
- ↑ Bassa Malondra A, García Gasalla M, Cladera A, Gaeau M «Endocarditis por Peptostreptococcus: presentación de dos casos y revisión de la literatura» (en castellà). An Med Interna, 2008 Maig; 25 (5), pp: 226-228. DOI: 10.4321/s0212-71992008000500006. ISSN: 0212-7199. PMID: 18769744 [Consulta: 30 novembre 2017].
- ↑ Principi, N, Esposito, S «Kingella kingae infections in children» (en anglès). BMC Infect Dis, 2015 Jul 7; 15, pp: 260. DOI: 10.1186/s12879-015-0986-9. PMC: 4494779. PMID: 26148872 [Consulta: 9 desembre 2020].
- ↑ Otero Reigada MC, Silveira LF, Policarpo SN, Pérez Tamarit MA, et al «Infecciones por Kingella kingae en la edad pediátrica» (en castellà). Enferm Infecc Microbiol Clin, 2011 Mar; 29 (Supl 3), pp: 29-32. DOI: 10.1016/S0213-005X(11)70024-6. ISSN: 0213-005X. PMID: 21458708 [Consulta: 15 agost 2017].
- ↑ Cho Y, Minami K, Kasai M, Kubota N, Higuchi T «Infective endocarditis due to multiple species of anaerobes following tricuspid valve replacement» (en anglès). J Microbiol Immunol Infect, 2017 Oct; 50 (5), pp: 733-734. DOI: 10.1016/j.jmii.2016.06.005. ISSN: 1684-1182. PMID: 27553447 [Consulta: 30 novembre 2017].
- ↑ Helsel LO, Hollis D, Steigerwalt AG, Morey RE, et al «Identification of Haematobacter, a New Genus of Aerobic Gram-Negative Rods Isolated from Clinical Specimens, and Reclassification of Rhodobacter massiliensis as Haematobacter massiliensis comb. nov.» (en anglès). J Clin Microbiol, 2007 Abr; 45 (4), pp: 1238-1243. DOI: 10.1128/JCM.01188-06. PMC: 1865840. PMID: 17287332 [Consulta: 3 novembre 2017].
- ↑ Buscher A, Li L, Han XY, Trautner BW «Aortic Valve Endocarditis Possibly Caused by a Haematobacter-Like Species» (en anglès). J Clin Microbiol, 2010 Oct; 48 (10), pp: 3791-3793. DOI: 10.1128/JCM.00238-10. PMC: 2953082. PMID: 20610676 [Consulta: 3 novembre 2017].
- ↑ Cheng JW, Wang P, Xiao M, Yuan Y, et al «First case report of endocarditis caused by Haematobacter massiliensis in China» (en anglès). BMC Infect Dis, 2017 Oct 31; 17 (1), pp: 709. DOI: 10.1186/s12879-017-2809-7. ISSN: 1471-2334. PMID: 29089026 [Consulta: 3 novembre 2017].
- ↑ Riddell J 4th, Kauffman CA, Smith JA, Assi M, et al «Histoplasma capsulatum endocarditis: multicenter case series with review of current diagnostic techniques and treatment» (en anglès). Medicine (Baltimore), 2014 Jul; 93 (5), pp: 186-193. DOI: 10.1097/MD.0000000000000034. PMC: 4602453. PMID: 25181311 [Consulta: 14 agost 2017].
- ↑ Hayani O, Higginson LA, Toye B, Burwash IG «Man's best friend? Infective endocarditis due to Capnocytophaga canimorsus» (en anglès). Can J Cardiol, 2009 Abr; 25 (4), pp: e130–e132. DOI: 10.1016/s0828-282x(09)70076-5. PMC: 2706773. PMID: 19340358 [Consulta: 15 agost 2017].
- ↑ Sakai, J; Imanaka, K; Kodana, M; Ohgane, K; et al «Infective endocarditis caused by Capnocytophaga canimorsus; a case report» (en anglès). BMC Infect Dis, 2019 Nov 4; 19 (1), pp: 927. DOI: 10.1186/s12879-019-4492-3. PMC: 6827180. PMID: 31684875 [Consulta: 30 desembre 2020].
- ↑ Barry, M «Double Native Valve Infective Endocarditis due to Capnocytophaga canimorsus: First Reported Case Caused by a Lion Bite» (en anglès). Case Rep Infect Dis, 2018 Feb 8; 2018, pp: 4821939. DOI: 10.1155/2018/4821939. PMC: 5822827. PMID: 29593919 [Consulta: 15 abril 2018].
- ↑ Balaj, C; Ottenin, MA; Henrion, D; Beguinot, I; et al «Native-valve tricuspid endocarditis due to Neisseria sicca with bilateral pulmonary embolism» (en anglès). Diagn Interv Imaging, 2013 Nov; 94 (11), pp: 1153-1155. DOI: 10.1016/j.diii.2013.07.003. ISSN: 2211-5684. PMID: 24007771 [Consulta: 30 desembre 2020].
- ↑ Kirlew C, Wilmot K, Salinas JL «Neisseria sicca Endocarditis Presenting as Multiple Embolic Brain Infarcts» (en anglès). Open Forum Infect Dis, 2015 Jul 8; 2 (3), pp: ofv105. DOI: 10.1093/ofid/ofv105. PMC: 4536332. PMID: 26284256 [Consulta: 5 octubre 2017].
- ↑ Tak, T; Reed, KD; Haselby, RC; McCauley Jr, CS; Shukla, SK «An update on the epidemiology, pathogenesis and management of infective endocarditis with emphasis on Staphylococcus aureus» (en anglès). WMJ, 2002 Feb; 101 (7), pp: 24-33. ISSN: 1098-1861. PMID: 12426917 [Consulta: 13 maig 2021].
- ↑ Galar, A; Weil, AA; Dudzinski, DM; Muñoz, P; Siedner, MJ «Methicillin-Resistant Staphylococcus aureus Prosthetic Valve Endocarditis: Pathophysiology, Epidemiology, Clinical Presentation, Diagnosis, and Management» (en anglès). Clin Microbiol Rev, 2019 Feb 13; 32 (2), pp: e00041-18. DOI: 10.1128/CMR.00041-18. PMC: 6431130. PMID: 30760474 [Consulta: 13 maig 2021].
- ↑ Cercenado, E «Staphylococcus lugdunensis: un estafilococo coagulasa negativo diferente de los demás» (en castellà). Enferm Infecc Microbiol Clin, 2009 Mar; 27 (3), pp: 139-142. DOI: 10.1016/j.eimc.2009.01.00 1. ISSN: 0213-005X. PMID: 19246125 [Consulta: 5 octubre 2017].
- ↑ David M, Loftsgaarden M, Chukwudelunzu F «Embolic Stroke Caused by Staphylococcus lugdunensis Endocarditis Complicating Vasectomy in a 36-Year-Old Man» (en anglès). Tex Heart Inst J, 2015 Des 1; 42 (6), pp: 585-587. DOI: 10.14503/THIJ-14-4566. PMC: 4665293. PMID: 26664319 [Consulta: 18 maig 2018].
- ↑ Fervenza FC, Contreras GE, Garratt KN, Steckelberg JM «Staphylococcus lugdunensis endocarditis: a complication of vasectomy?» (en anglès). Mayo Clin Proc, 1999 Des; 74 (12), pp: 1227-1230. DOI: 10.4065/74.12.1227. ISSN: 1942-5546. PMID: 10593351 [Consulta: 18 maig 2018].
- ↑ Connolly C, O'Donoghue K, Doran H, McCarthy FP «Infective endocarditis in pregnancy: Case report and review of the literature» (en anglès). Obstet Med, 2015 Jun; 8 (2), pp: 102-104. DOI: 10.1177/1753495X15572857. PMC: 4935011. PMID: 27512463 [Consulta: 5 octubre 2017].
- ↑ Arslan, F; Saltoglu, N; Mete, B; Mert, A «Recurrent Staphylococcus warnerii prosthetic valve endocarditis: A case report and review» (en anglès). Ann Clin Microbiol Antimicrob, 2011 Abr 23; 10, pp: 14. DOI: 10.1186/1476-0711-10-14. PMC: 3117683. PMID: 21513546 [Consulta: 26 febrer 2018].
- ↑ Flaherty JD, Levett PN, Dewhirst FE, Troe TE, et al «Fatal case of endocarditis due to Weissella confusa» (en anglès). J Clin Microbiol, 2003 Maig; 41 (5), pp: 2237-2239. ISSN: 1098-660X. PMC: 154740. PMID: 12734290 [Consulta: 12 abril 2018].
- ↑ Abeni C, Rota L, Ogliosi C, Bertocchi P, et al «Molecular epidemiology of Streptococcus bovis causing endocarditis and bacteraemia in Italian patients» (en anglès). J Med Case Rep, 2013 Jul 15; 7, pp: 185. DOI: 10.1186/1752-1947-7-185. PMC: 3750266. PMID: 23855909 [Consulta: 27 novembre 2017].
- ↑ Tripodi MF, Fortunato R, Utili R, Triassi M, Zarrilli R «Molecular epidemiology of Streptococcus bovis causing endocarditis and bacteraemia in Italian patients» (en anglès). Clin Microbiol Infect, 2005 Oct; 11 (10), pp: 814-819. DOI: 10.1111/j.1469-0691.2005.01248.x. ISSN: 1469-0691. PMID: 16153255 [Consulta: 27 novembre 2017].
- ↑ Cruz CS, Machado C, Almeida A, Moura RB «Streptococcus gallolyticus: a single bacteria, two different conditions» (en anglès). BMJ Case Rep, 2015 Jul 1; 2015, pii: bcr2014208998. DOI: 10.1136/bcr-2014-208998. PMC: 4493171. PMID: 26135668 [Consulta: 27 novembre 2017].
- ↑ Elliott, SP «Rat Bite Fever and Streptobacillus moniliformis» (en anglès). Clin Microbiol Rev, 2007 Gen; 20 (1), pp: 13-22. DOI: 10.1128/CMR.00016-06. PMC: 1797630. PMID: 17223620 [Consulta: 24 gener 2019].
- ↑ Maroto, F; Gallego, S; Pérez, C; Colon, C «Endocarditis infecciosa en enfermedad por mordedura de rata» (en castellà). Med Intensiva, 2011 Jun-Jul; 35 (5), pp: 317-318. DOI: 10.1016/j.medin.2010.07.013. ISSN: 1578-6749. PMID: 21122951 [Consulta: 30 desembre 2020].
- ↑ Torres-Miranda D, Moshgriz M, Siegel M «Streptobacillus moniliformis mitral valve endocarditis and septic arthritis: the challenges of diagnosing rat-bite fever endocarditis» (en anglès). Infect Dis Rep, 2018 Set 24; 10 (2), pii: 7731. DOI: 10.4081/idr.2018.7731. PMC: 6176473. PMID: 30344968 [Consulta: 24 gener 2019].
- ↑ Vázquez Fuentes N, Querol Gutiérrez JJ, Miralles Ibarra JM, De Torres RM, et al «Clínica: fiebre y artritis. Diagnóstico: endocarditis por enterococo» (en castellà). Reumatol Clin, 2007 Nov; 3 (6), pp: 273-275. DOI: 10.1016/S1699-258X(07)73703-8. ISSN: 1699-258X. PMID: 21794446 [Consulta: 19 febrer 2018].
- ↑ Pericàs JM, Corredoira J, Moreno A, García-País MJ, et al «Asociación entre la endocarditis infecciosa por Enterococcus faecalis y la neoplasia de colon: resultados preliminares a partir de una cohorte de 154 pacientes» (en castellà/anglès). Rev Esp Cardiol, 2017 Jun; 70 (6), pp: 451-458. DOI: 10.1016/j.recesp.2016.09.055. ISSN: 1885-5857. PMID: 27916708 [Consulta: 19 febrer 2018].
Enllaços externs modifica
- Endocarditis (infective, Libman-Sacks) - causes, symptoms, treatment & pathology Osmosis.org, 2016 Jul. (en anglès)
- Endocarditis infecciosa Dr. José Ignacio Mateo, 2014 Oct. (en castellà)
- Infective Endocarditis American Heart Association; 2021 Mar. (en anglès)