Fórmula de Rydberg
La fórmula [de] Rydberg[1][2] és usada en la física atòmica per descriure les longituds d'ones de les línies espectrals de molts elements químics. La fórmula va ser inventada pel físic suec Johannes Rydberg i presentada el 5 de novembre de 1888.
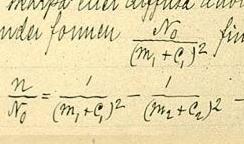
Història modifica
L'any 1880, Rydberg va treballar en una fórmula que descrivís la relació entre les longituds d'ona en les línies espectrals dels metalls alcalins. Es va adonar que les línies venien en sèries i va trobar que podia simplificar els seus càlculs usant el nombre d'ona (el nombre d'ones que ocupaven la unitat longitud, igual a 1/λ, la inversa de la longitud d'ona) com la seva unitat de mesura. Va representar les longituds d'ona de línies successives en cada sèrie enfront de nombres enters consecutius que representaven l'ordre de les línies en aquesta sèrie particular. Trobant que les corbes resultants tenien formes similars, va buscar una única funció capaç de generar totes aquestes corbes inserint la constant apropiada.
Primer va intentar amb la fórmula: , on n és la longitud d'ona de la línia, n0 és el límit de la sèrie, m és el nombre ordinal de la línia en la sèrie, m' és una constant diferent per a diferents sèries i C0 és una constant universal. Això no va funcionar massa bé.
Rydberg estava intentant: quan va veure la fórmula de Balmer per a l'espectre de l'hidrogen λ=hm² / (m² − 4).
Rydberg va reescriure la fórmula de Balmer en termes del nombre d'ones com a .
Això va mostrar que la fórmula de Balmer per a l'hidrogen era un cas especial amb i , on és la inversa de la constant de Blamer, (escrita com a B en comptes d'h per evitar-ne la confusió amb la constant de Planck). Avui dia aquesta constant és coneguda com a constant de Rydberg, i m com a defecte quàntic.
Expressar els resultats en termes del nombre d'ones, i no de la longitud d'ona, va ser la clau per al descobriment de Rydberg. El rol fonamental del nombre d'ones va ser també emfatitzat en el principi de combinació de Rydberg-Ritz del 1908. La raó fonamental per a això es troba en la mecànica quàntica. El nombre d'ones de la llum és proporcional a la freqüència i per això també és proporcional a l'energia quàntica de la llum E. Així, . Actualment sabem que els descobriments de Rydberg són un reflex de la simplicitat subjacent en el comportament de línies espectrals, en termes de diferències fixes d'energia (quantitzada) entre els orbitals de l'electró en l'àtom. L'expressió clàssica de Rydberg de 1888 per a la forma de les sèries espectrals no es va acompanyar d'una explicació física. El 1908, Walther Ritz en va fer una explicació pre-quàntica, segons ell, el mecanisme que hi havia rere les sèries espectrals era que els electrons en comportaven com a imants i podien vibrar respecte al nucli atòmic (si més no, temporalment) produint radiació electromagnètica.[3] Però aquesta teoria va ser superada el 1913 amb la presentació del model atòmic de Bohr.
En la concepció de l'àtom de Bohr, els nombres enters de Rydberg (i Balmer) n representen les òrbites a diferents distàncies enteres de l'àtom. Una freqüència (o energia espectral) emesa en una transició des de n1 a n₂ per tant, representa l'energia del fotó emès o absorbit quan un electró fa un salt des de l'orbital 1 fins a l'orbital 2.
Fórmula de Rydberg per a l'hidrogen modifica
On
- és la longitud d'ona de la llum emesa en el buit,
- és la constant de Rydberg per a l'hidrogen,
- i són sencers tal que ,
Reemplaçant per 1 i deixant funcioni a partir del 2 a l'infinit, les línies espectrals conegudes com les sèries de Lyman convergeixen a 91 nm són obtingudes, de la mateixa manera:
| Nom | Convergeix a | ||
| 1 | Sèrie de Lyman | 91 nm | |
| 2 | Sèrie de Balmer | 365 nm | |
| 3 | Sèrie de Paschen | 821 nm | |
| 4 | Sèrie de Brackett | 1459 nm | |
| 5 | Sèrie de Pfund | 2280 nm | |
| 6 | Sèrie de Humphreys | 3283 nm |
La sèrie de Lyman està en l'espectre ultraviolat mentre que la sèrie de Balmer està en l'espectre visible i la sèrie de Paschen, Brackett, Pfund i Humphrey estan en l'espectre infraroig.
Fórmula de Rydberg per a qualsevol element similar a l'hidrogen modifica
La fórmula de dalt pot ser estesa per a l'ús amb qualsevol element químic similar a l'hidrogen.
on
- és la longitud d'ona de la llum emesa en el buit;
- és la constant de Rydberg per a aquest element;
- és el nombre atòmic, és a dir el nombre de protons en el nucli atòmic d'aquest element;
- i són sencers tal que .
És important notar que aquesta fórmula només pot ser usada per a àtoms similars a l'hidrogen, també anomenats àtoms hidrogènics o hidrogenoides d'elements químics, és a dir amb un únic electró sent afectat per càrrega nuclear efectiva. Exemples inclourien He+, Li2+, Be3+ etc., on cap altre electró existeix en l'àtom.
La fórmula de Rydberg proporciona les longituds d'ona correctes per als electrons extremadament distants, on la càrrega nuclear efectiva pot ser estimada igual que la de l'hidrogen, ja que tots sinó una de les càrregues nuclears han estat pantallejades per altres electrons, i la base de l'àtom té una càrrega positiva de +1.
Finalment, amb certes modificacions (reemplaçament de Z per Z-1, i l'ús d'enters 1 i 2 per a les n per donar un valor numèric de 3/4 per a les diferències dels seus inversos al quadrat), la fórmula de Rydberg proporciona valors correctes en els casos especials de línies K-alfa, des de la transició en la pregunta si és K-alfa una transició de l'electró des de l'orbital 1s fins a l'orbital 2p. Aquest és l'anàleg a la línia alfa de Lyman en transició per a l'hidrogen, i té el mateix factor de freqüència. A causa que l'electró 2p no és pantallejat per cap altre electró en l'àtom des del nucli, la càrrega nuclear és disminuïda només per l'únic electró restant 1s, causant que el sistema sigui efectivament un àtom hidrogenoide, però amb una càrrega nuclear disminuïda Z-1. La seva freqüència és així: la freqüència de Lyman-alfa per a l'hidrogen, incrementat per un factor (Z-1)2. Aquesta fórmula de f = c/λ = freqüència Lyman-alfa* (Z-1)² és històricament coneguda com a llei de Moseley (havent afegit el factor c per convertir la longitud d'ona en freqüència), i pot usar-se per predir longituds d'ona de Kα (K-alfa) línies d'elements químics amb emissions espectrals de rajos X des d'alumini fins a or. Veure la biografia d'Henry Moseley per a la importància històrica d'aquesta llei, la qual va ser derivada empíricament al voltant del mateix temps que va ser explicat el model atòmic de Bohr.
Per a altres transicions espectrals en àtoms amb més d'un electró, la fórmula de Rydberg generalment ens dona resultats incorrectes a causa que la magnitud de l'efecte pantalla per a les transicions dels electrons externs és variable i no és possible compensar-la d'una manera tan simple com l'anterior.
Referències modifica
- ↑ Química general (en castellà). Reverte, 1 de gener de 1975. ISBN 9788429170412.
- ↑ Barrow, Gordon M. Química física (en castellà). Reverte, 1 gener 1987. ISBN 9788429170580.
- ↑ Ritz, W. «Magnetische Atomfelder und Serienspektren». Annalen der Physik, 330, 4, 1908, pàg. 660–696. Bibcode: 1908AnP...330..660R. DOI: 10.1002/andp.19083300403.
- Mike Sutton, “Getting the numbers right – the lonely struggle of Rydberg” Chemistry World, Vol. 1, No. 7, July 2004.
- Martinson, Indrek; L.J. Curtis «Janne Rydberg – his life and work». NIM B, 235, 2005, pàg. 17-22 [Consulta: 1r abril 2010].