Àcid fluoroantimònic
L'àcid fluoroantimònic (HSbF₆) és una mescla de fluorur d'hidrogen i pentafluorur d'antimoni en diverses proporcions.[1] La proporció 1:1 condueix al superàcid més fort conegut, el qual s'ha demostrat que protona fins i tot els hidrocarburs per produir carbocations i H₂.
 | |
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 235,90480295155 Da |
| Estructura química | |
| Fórmula química | HSbF₆ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Altres | |
| superàcid | |
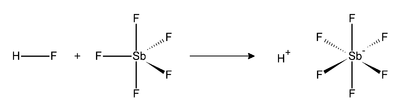
La reacció de fluorur d'hidrogen (HF) i SbF₅ és exotèrmica. HF allibera el catió (H+), i la seva base conjugada (F−) és segrestada per una o més molècules de SbF₅ per produir SbF₆− octaèdric. Aquest anió es classifica com no coordinant, perquè és tant un nucleòfil feble i una base molt feble. El catió H+ roman efectivament "nu", la qual cosa té com a conseqüència l'extrema acidesa del sistema. L'àcid fluoroantimònic és 2×1019 vegades més fort que l'àcid sulfúric. La reacció del fluorur d'hidrogen i pentafluorur d'antimoni procedeix com segueix:
Estructura
modificaS'han cristal·litzat dos productes relacionats amb les mescles HF-SbF₅, i tots dos han estat analitzats per cristal·lografia de raigs X d'un sol cristall. Aquestes sals tenen les fórmules [H₂F+][Sb₂F11−] i [H₃F₂+][Sb₂F11−]. En ambdues sals, l'anió és Sb₂F11−.[2] Com s'ha esmentat anteriorment, SbF₆− està classificat com una base feble; el monoanió de major grandària Sb₂F11− seria encara més feble.
Comparació amb altres àcids
modificaEls següents valors estan basats en la funció d'acidesa de Hammett. L'acidesa s'indica amb valors negatius d'H0.
- Àcid fluoroantimònic (1990) (valor H0 = −31.3)
- Àcid màgic (1974) (valor H0 = −19.2)
- Superàcid carborà (1969) (valor H0 = −18.0)
- Àcid fluorosulfúric (1944) (valor H0 = −15.1)
- Àcid tríflic (1940) (valor H0 = −14.9)
Aplicacions
modificaAquest àcid extraordinàriament fort protona gairebé tots els compostos orgànics. El 1967, Bickel i Hogeveen van mostrar que la mescla HF-SbF₅ elimina H₂ del metilpropaà i metà del neopentà:[3][4]
- (CH₃)₃CH + H+ → (CH₃)₃C+ + H₂
- (CH₃)₄C + H+ → (CH₃)₃C+ + CH₄
Seguretat
modificaHF-SbF₅ es descompon per acció de l'aigua de forma ràpida i explosiva. Reacciona amb pràcticament tots els solvents coneguts.[1] Alguns solvents que s'ha provat que són compatibles amb HF-SbF₅ són el clorofluorur de sulfuril i l'òxid de sofre (IV). També s'han usat cloloflurorurcarbons solvents. Els contenidors per HF-SbF₅ estan fets de PTFE.
Referències
modifica- ↑ 1,0 1,1 Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. “Hydrogen Fluoride–Antimony(V) Fluoride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ Mootz, D.; Bartmann, K. «The Fluoronium Ions H₂F+ and H₃F₂+: Characterization by Crystal Structure Analysis». Angewandte Chemie, International Edition in English, 27, 1988, pàg. 391–392. DOI: 10.1002/anie.198803911.
- ↑ Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. «Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen». Chemical Communications, 1967, 1967, pàg. 634–5. DOI: 10.1039/C19670000634.
- ↑ Hogeveen, H.; Bickel, A. F. «Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons». Chemical Communications, 1967, 1967, pàg. 635–6. DOI: 10.1039/C19670000635.