Herpesvirus humà 8
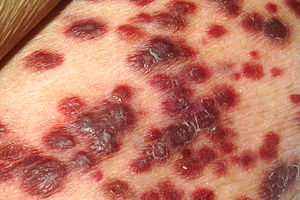
Herpesvirus humà 8, VHH-8 o virus del sarcoma de Kaposi és un Rhadinovirus. Va ser identificat l'any 1994[1] com a responsable d'aquest tipus de càncer, que ataca les persones immunodeprimides i que es va convertir en l'herald d'una nova epidèmia, la del sida, quan va començar a aparèixer amb una freqüència abans desconeguda entre homes homosexuals dels Estats Units.
| Human herpesvirus 8 | |
|---|---|
 | |
| Taxonomia | |
| Regne | Heunggongvirae |
| Fílum | Peploviricota |
| Classe | Herviviricetes |
| Ordre | Herpesvirales |
| Família | Herpesviridae |
| Gènere | Rhadinovirus |
| Espècie | Human herpesvirus 8 |
Descobriment
modificaSe sospitava des de feia decennis que el càncer conegut com a sarcoma de Kaposi havia d'estar relacionat amb una causa infecciosa. Al 1994, l'equip de Y. Chang va poder demostrar la presència d'un herpesvirus nou associat a aquest sarcoma.[1] El VHH-8 és el primer dels vuit herpesvirus coneguts a haver estat identificat a través de tècniques moleculars, ja no per cultiu cel·lular, amplificant dos gens estranys trobats en tumors de Kaposi que van resultar pròxims a altres coneguts: respectivament, de virus d'Epstein-Barr i d'un herpevirus de la mona esquirol.[2]
Classificació
modificaEl VHH-8 és un herpesvirus (fam. Herpesviridae) enquadrat en la subfamília Gammaherpesvirinae i en el gènere Rhadinovirus. Tot i que el gènere Rhadinovirus està extensament representat entre els primats, tant del Vell com del Nou Món, aquest és el primer que es troba en l'espècie humana. Els herpesvirus són virus ADN de cadena doble, de manera que la classificació de Baltimore els inclou en el grup I.
Epidemologia
modificaPrevalença
modificaLa prevalença (proporció d'individus infectats) és molt variable quan es comparen regions i grups de risc.[3] La taxa més alta (fins a 50%) s'observa a l'Àfrica central. La taxa és també elevada, encara que menys i de forma heterogènia (10-20%), als països de la Mediterrània. És d'aquests països d'on és característica la variant del sarcoma de Kaposi que es sol anomenar «endèmica». Als Estats Units són les poblacions d'aquests orígens les que el presenten amb major freqüència. La resta de les poblacions, com les d'Europa Central i Septentrional, l'Est o al Sud d'Àsia, presenten prevalences de menys del 5%. En aquestes poblacions, però, la prevalença és major en homes homosexuals.
Transmissió
modificaA les regions geogràfiques on la prevalença és baixa la principal manera de transmissió és per relacions sexuals transanals en parelles heterosexuals o homosexuals. L'ADN viral s'observa en l'esperma, encara que escàs, i en la saliva. En la transmissió heterosexual, que actualment no és rara, la prevalença és major entre dones amb antecedents de malalties de transmissió sexual, com la sífilis.[4]
La prevalença entre la població d'hemofílics i transfosos en països de baixa prevalença no és major que entre donants de sang, el que semblaria indicar que la transfusió no és una manera significativa d'infecció. No obstant això un estudi recent a Uganda, on la seropositivitat VHH-8 és molt alta, indica que la transfusió provoca la seroconversió amb una freqüència significativa (inferior en qualsevol cas al 5%).[5]
Als països d'alta prevalença, sobretot a l'Àfrica Central, les dades epidemiològiques revelen que la seropositivitat s'aconsegueix en la major part dels casos abans de la pubertat, el que exclou les relacions sexuals com a forma principal de transmissió. La prevalença és baixa en nounats, de manera que, a diferència del que passa amb el VIH, la transmissió no sembla lligada al part o l'alletament. S'ha postulat que l'ús de la saliva per part de la mare en la cura de les picades d'insectes pot ser un dels principals mecanismes implicats.[6]
Patologies associades
modificaL'HHV-8 no produeix només el sarcoma de Kaposi, sinó també dues malalties limfoproliferatives: el limfoma efusiu primari i la malaltia multicèntrica de Castleman. Encara que en el primer cas la presència activa de virus i els mecanismes moleculars de la patogènesi són ben coneguts, en els altres dos l'activitat lítica és menor (encara que la seroprevalença en els pacients és un 100%) i els mecanismes encara no es coneixen.[7]
El limfoma efusiu primari és un limfoma de cèl·lules B que no produeix masses tumorals evidents, però sí efusions en les cavitats corporals. El VHH-8 s'identifica en el 100% dels casos, i l'OMS ho considera part de la llista de malalties indicatives de el desenvolupament de la sida, encara que pot presentar-se en pacients seronegatius pel VIH.
La malaltia multicèntrica de Castleman produeix limfadenopaties i hiperglobulinemia, entre d'altres signes. El VHH-8 es detecta en els òrgans afectats de més del 95% dels pacients positius per al VIH i en el 40% dels negatius. Les lesions es consideren no malignes, però la condició predisposa pel desenvolupament del limfoma no hodgkinià (limfoma associat a la sida).
Història natural
modificaL'evolució natural de la infecció (la seva història natural) depèn de la manera d'infecció i distingeix a les variants del sarcoma de Kaposi. En la forma clàssica, que es presenta amb freqüència en homes ancians de països mediterranis, la progressió de la malaltia pot requerir dècades. La forma endèmica que afecta molts nens i adults a l'Àfrica tarda mesos a progressar. L'avanç més ràpid és el que es dona en el sida en absència de tractament, perquè quan apareix pot requerir mesos o només setmanes. En pacients inmunosuprimits, generalment en relació amb trasplantaments, la progressió dura mesos, però s'atura si es restaura la condició immunitària normal.
La majoria de les persones seropositives pel virus VHH-8 no presenten símptomes, és a dir, la infecció no es presenta com a malaltia. La incubació en els seropositius per VIH, el virus de la sida, de les malalties provocades pel VHH-8 pot ser més o menys llarga i sembla dependre del grau de progressió de la immunodepressió pròpia de la sida, més que del temps d'infecció per VHH-8. Tant el sarcoma de Kaposi com la malaltia de Castleman han disminuït radicalment en la seva incidència, amb la introducció de les teràpies antiretrovirals d'alta actividad.[3]
Patogènesi
modificaAl voltant d'una sisena part dels casos de càncer són provocats per virus, i la incidència és major en els països menys desenvolupats.[8] Els virus que provoquen càncer es reparteixen entre diversos grups, entre els quals s'inclou a dues famílies de virus ARN i a totes les de virus amb ADN (grups I i II de la classificació de Baltimore), excepte els parvovirus (fam. Parvoviridae).[9] La infecció pel virus no implica automàticament el desenvolupament d'un càncer, i la prevalença de la infecció sempre és molt més gran, i s'observen períodes de latència sovint molt llargs. La immunodepressió, qualsevol que sigui la causa, augmenta la probabilitat de el càncer entre els seropositius per al virus cancerogènic. En el cas del VHH8, la prevalença en la població mundial s'ha estimat entre un 2 i un 8%,[10] però només amb la irrupció de l'epidèmia de VIH i la immunosupressió que provoca (SIDA) el sarcoma de Kaposi s'ha tornat relativament freqüent en grups d'edat i regions on abans era gairebé desconegut.
A diferència del que passa quan el virus cancerogènic és de tipus ARN, els oncogèns implicats no són variants dels gens cel·lulars, sinó gens propis de virus, i són essencials tant per a la replicació viral com per a la transformació de les cèl·lules en canceroses. El VHH8 posseeix un nombre de gens homòlegs dels de la regulació cel·lular, inclosos gens relatius a les quemoquines, els factors de proliferació cel·lular, les molècules del sistema de comunicació intercel·lular i els inhibidors de la apoptosis.[9]
L'antigen LANA1 (de l'anglès latency-associated nuclear antigen 1) amb el factor de transcripció Sp1, transactivando el promotor TERT i contribuint a l'elongació dels telòmers, el que produeix una «immortalització» de les línies cel·lulars afectades. Els antígens LANA1 i LANA2 afecten negativament el treball del gen P53. El primer inhibeix la mort cel·lular dependent del P53. El segon és específic de les cèl·lules B, a les quals confereix major supervivència, el que representaria un mecanisme major en la promoció de limfomes pel HHV8.
Tant l'HHV8 com el virus d'Epstein-Barr presenten, a més del seu joc exclusiu de proteïnes oncogenèticas, altres que presenten homologia de seqüència amb proteïnes cel·lulars, encara que sense els introns que es troben en aquestes. S'interpreta que poden procedir de la retrotranscripció d'ARNm amb ajuda retroviral[11] o ser el resultat de convergència evolutiva.
Bibliografia
modificaDues revisions modernes que contenen la informació més rellevant i moltes referències addicionals:
- Cathomas, G. (2003). Kaposi's sarcoma-associated herpesvirus (KSHV)/human herpesvirus 8 (HHV-8) as a tumour virus. Herpes 10(3), 72-7. PMID: 14759339.
- Plancoulaine, S., and Gessain, A. (2005). Aspects épidémiologiques de l'herpèsvirus humain 8 (HHV-8) et du sarcome de Kaposi. Méd. Mal. Infect. 35(5), 314-21. PMID: 15907610.
Referències
modifica- ↑ 1,0 1,1 Y. Chang; E. Cesarman; M. S. Pessin; F. Lee; J. Culpepper; D. M. Knowles; P. S. Moore «Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi's sarcoma». Science, 266, 5192, 1994, pàg. 1865-1869. PMID: 7997879.
- ↑ S. Plancoulaine; A. Gessain «Aspects épidémiologiques de l'herpèsvirus humain 8 (HHV-8) et du sarcome de Kaposi». Médecine et Maladies Infectieuses, 35, 5, 2005, pàg. 314-321. PMID: 15907610.
- ↑ 3,0 3,1 K. Antman; Y. Chang «Kaposi's sarcoma». N Engl J Med, 342, 14, 2000, pàg. 1027-1038. PMID: 10749966.
- ↑ R. Tedeschi; L. Caggiari; I. Silins; I. Kallings; A. Andersson-Ellstrom; P. De Paoli; J. Dillner «Seropositivity to human herpesvirus 8 in relation to sexual history and risk of sexually transmitted infections among women». Int J Cancer, 87, 2, 2000, pàg. 232-235.
- ↑ W. Hladik; S. C. Dollard; J. Mermin; A. L. Fowlkes; R. Downing; M. M. Amin; F. Banage; E. Nzaro; P. Kataaha; T. J. Dondero; P. E. Pellett; E. M. Lackritz «Transmission of human herpesvirus 8 by blood transfusion». N Engl J Med, 355, 13, 2006, pàg. 1331-1338. PMID: 17005950.
- ↑ M. Coluzzi; M. L. Calabro; D. Manno; L. Chieco-Bianchi; T. F. Schulz; V. Ascoli «HHV-8 transmission via saliva to soothe blood-sucking arthropod bites». Br J Cancer, 91, 5, 2004, pàg. 998-999; author reply 999. PMID: 15305196.
- ↑ G. Cathomas «Kaposi's sarcoma-associated herpesvirus (KSHV)/human herpesvirus 8 (HHV-8) as a tumour virus». Herpes, 10, 3, 2003, pàg. 72-77. PMID: 14759339.
- ↑ D. Elgui de Oliveira «DNA viruses in human cancer: An integrated overview on fundamental mechanisms of viral carcinogenesis». Cancer Lett, in press, 2006. PMID: 16814460.
- ↑ 9,0 9,1 J. S. Butel «Viral carcinogenesis: revelation of molecular mechanisms and etiology of human disease». Carcinogenesis, 21, 3, 2000, pàg. 405-426. PMID: 10688861.
- ↑ J. C. Leao; S. Porter; C. Scully «Human herpesvirus 8 and oral health care: an update». Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 90, 6, 2000, pàg. 694-704. PMID: 11113813.
- ↑ J. Nicholas «Evolutionary aspects of oncogenic herpesviruses». Mol Pathol, 53, 5, 2000, pàg. 222-237. PMID: 11091846.
Enllaços externs
modifica- Capitol dedicat al VHH-8 en un curs de virologia. Clar, però no gaire actualitzat (en castellà)
- Human Herpesvirus-8: Related Resources Arxivat 2008-09-17 a Wayback Machine. HIV InSite (en anglès)