Rebuig de trasplantament
El rebuig de trasplantament es produeix quan un òrgan o teixit trasplantat no és acceptat per l'organisme del receptor. La causa d'aquest fenomen és que el sistema immunitari del receptor ataca l'empelt o estructura trasplantada.[1] Això és un fet previsible, ja que la funció del sistema immunitari és reconèixer molècules estranyes a l'organisme i provocar el desencadenament de mecanismes immunològics que les destrueixin, de forma semblant a com passa amb microorganismes patògens com bacteris i virus. Sempre s'intenta buscar el màxim grau d'histocompatibilitat entre donant i receptor per minvar la probabilitat de rebuig immunològic analitzant els seus respectius grups sanguinis i proteïnes HLA. Tanmateix, el tractament amb fàrmacs immunosupressors també té l'objectiu d'evitar el rebuig. Abans del trasplantament aquests fàrmacs disminueixen l'activitat del sistema immunitari i, per tant, la seva capacitat de reconeixement de molècules estranyes. Posteriorment al trasplantament, el receptor ha de seguir el tractament amb fàrmacs immunosupressors per evitar un possible rebuig tardà o crònic (al cap de 3 o més mesos del trasplantament).
 | |
| Tipus | malaltia relacionada amb el trasplantament |
|---|---|
| Classificació | |
| CIM-11 | NE84 |
| CIM-10 | T86 |
| Recursos externs | |
| Enciclopèdia Catalana | 0206026 |
| MedlinePlus | 000815 |
| MeSH | D006084 |
| UMLS CUI | C0018129 |
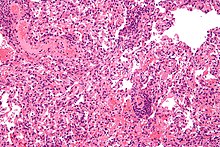
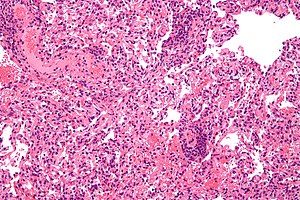
Tipus de rebuig
modificaRebuig hiperagut
modificaEl rebuig hiperagut és una resposta del sistema del complement que es produeix en receptors de trasplantament amb anticossos contra el donant ja existents (per exemple, els anticossos sanguinis AB0). Aquest rebuig es produeix uns minuts després del trasplantament i ha de ser eliminat immediatament per evitar una síndrome de resposta inflamatòria sistèmica (SIRS, de l'anglès Systemic Inflammatory Response Syndrome). Es produeix una ràpida aglutinació de la sang a causa de les unions antigen-anticòs. Això és un risc especialment important en els trasplantaments de ronyó, fet pel qual es realitza una prova bioquímica abans del trasplantament per comprovar que en el receptor no hi hagi anticossos contra els antígens d'histocompatibilitat del donant. El rebuig hiperagut és anàleg a una reacció contra una transfusió de sang, ja que és una resposta immunitària humoral. Per a la resta d'òrgans, s'evita el rebuig amb empelts de donadors amb un grup sanguini compatible amb el del receptor. En els trasplantaments de fetge i trasplantaments cel·lulars el rebuig hiperagut no suposa un problema, ja que aquests tenen una capacitat de regeneració molt elevada. També es pot produir rebuig hiperagut com a resultat de xenotrasplantaments (trasplantaments entre espècies diferents) a receptors als quals no se'ls ha administrat immunosupressors.
Rebuig agut
modificaEl rebuig agut pot començar a partir d'una setmana després del trasplantament (a diferència del rebuig hiperagut, que es produeix de manera relativament immediata). El risc de patir aquest tipus de rebuig és màxim en els tres primers mesos després del trasplantament. Tot i això, també es pot produir al cap d'uns anys. Un episodi puntual de rebuig agut no és un problema greu si es tracta adequadament, i rarament desemboca en una disfunció de l'òrgan. No obstant, episodis repetits de rebuig agut poden acabar en un rebuig crònic (vegeu més avall).
El rebuig agut es produeix en diferent grau en tots els trasplantaments (excepte en els trasplantaments entre bessons univitel·lins) sempre que el sistema immunitari no s'alteri amb l'ús d'immunosupressors. Això és degut a la incompatibilitat entre el sistema d'antígens d'histocompatibilitat (HLA, de l'anglès Human Leukocyte Antigen), present a les superfícies de membrana de totes les cèl·lules de l'organisme. Hi ha un gran nombre d'al·lels diferents per cada HLA, així que una coincidència perfecta entre tot l'HLA del teixit del donant i el de l'organisme del receptor és pràcticament impossible. Els òrgans com els ronyons o el fetge, que estan altament vascularitzats (rics en vasos sanguinis), són normalment les primeres víctimes del rebuig agut. La detecció de danys en l'endoteli dels vasos sanguinis és un factor clau per prevenir un rebuig agut irreversible.
La raó per la qual el rebuig agut ocorre com a mínim una setmana després del trasplantament és la lenta activació dels limfòcits T implicats. Normalment els òrgans que es trasplanten s'obtenen d'un cadàver (per exemple d'una mort per traumatisme), així que solen estar ja en estat d'inflamació. Per aquest motiu, aquests òrgans presenten leucòcits que migraran cap als òrgans limfàtics secundaris del receptor (per exemple als ganglis limfàtics). Allà presentaran el seu propi antigen derivat de l'òrgan del donant als limfòcits T del receptor. Aquests limfòcits T que interaccionen amb complexos d'HLA diferents als seus són propensos a activar-se i desenvolupar una resposta immunitària contra el mateix pèptid; contra la molècula al·logènica d'HLA; o contra una combinació d'ambdues. Abans de començar la reacció, però, hauran de diferenciar-se. Un cop diferenciades provocaran la lisi de les cèl·lules de l'òrgan trasplantat o elaboraran citocines que causaran la necrosi del teixit. Aquest procés pot trigar dies, o fins i tot setmanes, en manifestar-se.
El primer trasplantament d'òrgans amb èxit, dut a terme el 1954 pel Dr. Joseph Murray, fou reeixit perquè el donant i el receptor eren bessons univitel·lins, així que no es produïren reaccions de rebuig en absolut. El diagnòstic del rebuig agut es basa en els signes i símptomes del pacient, en proves de laboratori i, com a últim cas, en biòpsies del teixit. Aquestes biòpsies són interpretades pel patòleg en qüestió, que detecta canvis en el teixit que suggereixen rebuig. En general, el patòleg busca tres característiques histològiques. La primera és la presència de limfòcits T infiltrant-se al teixit trasplantat; això pot anar acompanyat d'una col·lecció heterogènia de cèl·lules immunitàries com eosinòfils -acidòfils-, plasmòcits i neutròfils (les proporcions d'aquestes cèl·lules pot ser útil per a determinar quin tipus de rebuig s'està produint). La segona és l'evidència de danys al teixit trasplantat -aquests danys depenen del tipus de teixit en concret. La darrera és la presència de danys en els vasos sanguinis del teixit.
Els darrers progressos tecnològics han dut a l'estudi de l'expressió genètica a través d'anàlisis sanguínies. Aquests tests, com l'AlloMap Molecular Expression Testing, amb un alt valor predictiu negatiu (probabilitat d'estar sa després d'haver observat un resultat negatiu a la prova), ajuden a la detecció del rebuig agut. Tots aquests tipus de proves són específiques per a cada tipus de teixit.
Rebuig crònic
modificaL'expressió rebuig crònic va ser inicialment emprada per denominar a una pèrdua de funció a llarg termini en òrgans trasplantats associada a un procés de fibrosi dels vasos sanguinis de l'empelt trasplantat. Però ara per ara, aquesta patologia és denominada com vasculopatia de l'empelt. El terme rebuig crònic està reservat a casos de rebuig amb una resposta immune inflamatòria contra d'empelt del que actualment se sap poca cosa.
Rebuig crònic pulmonar
modificaEl rebuig crònic després d'un trasplantament de pulmó és la principal afecció a llarg termini en pacients amb trasplantament de pulmó.[2][3][4] L'esperança de vida mitjana d'aquests pacients després del trasplantament és 4,7 anys (aproximadament la meitat que la d'altres receptors d'òrgans). Histiopatològicament, l'afecció és coneguda com a Bronquiolitis obliterant. Clínicament, aquests pacients presenten dificultats respiratòries progressives, sovint associades a dispnea i tos. En última instància, l'afecció deriva en insuficiència pulmonar o bé en infecció secundària. La bronquiolitis obliterant s'utilitza per qualificar pacients amb una obstrucció respiratòria que no pot ser atribuïda a qualsevol altra causa específica.
Aquest diagnòstic es confirma gràcies a una disminució persistent (de tres o més setmanes) del volum d'expiració forçada (forced expiratory volume) d'almenys un 20%. Tanmateix, la bronquiolitis obliterant és freqüent en pacients que han rebut un trasplantament de pulmó. La pateixen almenys un 50% d'aquests pacients al cap de 5 anys i un 80% als deu anys després del trasplantament.[5]
Mecanismes de rebuig
modificaEl rebuig és una resposta immunitària secundària controlada pels limfòcits T i els mecanismes de resposta immunitària humoral (anticossos). El nombre d'al·lels incompatibles entre donador i receptor determina la velocitat i la magnitud de la resposta de rebuig. Hi ha diferents mecanismes de rebuig que actuaran segons l'empelt, com mostra aquesta taula:
| Òrgan/teixit | Mecanisme |
|---|---|
| Sang | Anticossos |
| Ronyó | Anticossos, CMI |
| Cor | Anticossos, CMI |
| Pell | CMI |
| Medul·la òssia | CMI |
| Còrnia | Normalment és acceptada sempre que no estigui vascularitzada, CMI |
CMI = immunitat controlada per cèl·lules (cell mediated immunity)
Tractament del rebuig
modificaEl rebuig crònic de trasplantaments és irreversible i no es pot tractar de forma efectiva. Tractaments amb ciclosporina inhalada estan sent investigats com a mitjans per a retardar o prevenir el rebuig crònic de pulmons. Avui en dia, l'únic tractament definitiu és el retrasplantament si el pacient pot ser reassignat i hi ha donants disponibles.
El rebuig agut de trasplantaments es pot tractar mitjançant drogues quimioterapèutiques dissenyades per suprimir la resposta immunitària (vegeu la llista de sota). El rebuig agut és tractat normalment amb un procés curt d'elevades dosis de corticoesteroides, que sol ésser suficient. Si no és així, el procés es pot repetir o bé es pot utilitzar una triple teràpia, que consisteix en corticoesteroides, un inhibidor de la calcineurina i un agent antiproliferatiu. També es poden afegir anticossos contra components específics del sistema immunitari, especialment en pacients d'alt risc. Inhibidors del mTOR es poden utilitzar en pacients específics, en els quals no es recomana fer ús dels inhibidors de la calcineurina o els agents antiproliferatius. Un rebuig agut d'aquests tractaments pot requerir transfusions de sang per tal d'eliminar els anticossos contra el trasplantament. Si és possible fer un trasplantament de medul·la òssia, el sistema immunitari del receptor pot ser substituït pel del donant, permetent així que el cos del receptor accepti el nou òrgan sense risc de rebuig. Això requereix que la medul·la òssia, que produeix les cèl·lules immunitàries, sigui del donant de l'òrgan (o del seu bessó idèntic, o un clon). Hi ha un risc de malaltia empelt contra receptor o GVHD (de l'anglès graft versus host disease) en la qual els limfòcits de medul·la òssia trasplantada reconeixen els teixits de l'hoste com estranys i, en conseqüència, els ataquen i destrueixen.
Fàrmacs immunosupressors utilitzats pel tractament del rebuig de trasplantaments
modifica- Inhibidors de la calcineurina:
- Inhibidors del mTOR
- Antiproliferatius
- Corticosteroides
- Anticossos
- Anticossos monoclonals contra receptors IL-2Rα:
- Anticossos policlonals contra limfòcits T:
- Globulina anti-timòcits (ATG)
- Globulina anti-limfòcits (ALG)
- Anticossos monoclonals anti-CD20
L'anticòs monoclonal contra limfòcits T OKT3 era utilitzat antigament en la prevenció del rebuig, i és sovint utilitzat en el tractament de rebuig sever, però ja no es fa servir massa degut al greu síndrome d'alliberació de citosines (de l'anglès cytokine release syndrome) i al trastorn limfoproliferatiu post-trasplantament, tots dos relacionats amb l'ús d'aquesta droga.
El diagnòstic actual de rebuig d'òrgans després d'un trasplantament depèn d'una biòpsia del teixit, la qual cosa no és ideal perquè les mostres són limitades i hi ha riscos associats al procediment invasiu. Una MRI de cèl·lules immunitàries marcades in vivo ofereix un apropament no invasiu que permet detectar i monitorar el rebuig de l'empelt després d'un trasplantament d'òrgan. L'aplicació clínica d'una tècnica no invasiva i fiable que detecti els símptomes primerencs del rebuig d'empelt millorarà tant el tractament terapèutic dels pacients amb trasplantaments, així com la seva qualitat de vida.
Referències
modifica- ↑ Frohn C, Fricke L, Puchta JC, Kirchner H. "The effect of HLA-C matching on acute renal transplant rejection". Nephrol Dial Transplant. 16:355-60
- ↑ Pediatr Transplant. 2005 Feb;9(1):84-93
- ↑ Eur Respir J Suppl. 2003 Nov;47:57s-64s
- ↑ http://www.OPTN.org Arxivat 2014-06-09 a Wayback Machine.
- ↑ Am J Respir Crit Care Med. 2007 Jun 1;175(11):1192-8
Bibliografia
modifica- Gorman, Rachael Moeller. "The Transplant Trick, Arxivat 2013-06-11 a Wayback Machine." Proto, Spring 2009.
Enllaços externs
modifica| Vegeu rebuig en el Viccionari, el diccionari lliure. |