Síntesi proteica
La síntesi de proteïnes o proteogènesi és el procés anabòlic mitjançant el qual es formen les proteïnes a partir dels aminoàcids. És el pas següent a la transcripció de l'ADN a ARNm. El terme síntesi proteica de vegades es fa servir per a referir-se únicament a la traducció genètica però, amb més freqüència, es refereix a un procés de múltiples etapes que comença amb la síntesi d'aminoàcids i la transcripció genètica de l'ADN nuclear a l'ARN missatger, el qual es fa servir com un input per a la traducció.
El procés de la síntesi proteica consta de dues etapes, la traducció genètica de l'ARN missatger, mitjançant el qual els aminoàcids s'ordenen de manera precisa a partir de la informació continguda en la seqüència de nucleòtids de l'ADN, i les modificacions posteriors a la traducció que experimenten els polipèptids formats així fins a arribar al seu estadi funcional. Com que la traducció genètica és la fase més important de la síntesi de proteïnes, sovint es considera sinònim de traducció.[1]
Característiques de la síntesi proteica
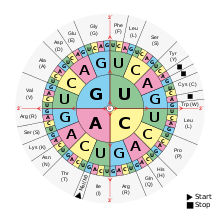
modificaCom que existeixen 20 aminoàcids diferents i només hi ha quatre nucleòtids a l'ARNm (Adenina, Uracil, Citosina i Guanina), és evident que la relació no pot ser un aminoàcid per cada nucleòtid, ni tampoc per cada dos nucleòtids, ja que els quatre, presos de dos en dos, només donen setze possibilitats. La colinearietat ha d'establir-se com a mínim entre cada aminoàcid i triplets de nucleòtids. Com que hi ha seixanta-quatre triplets diferents (combinació de quatre elements o nucleòtids presos de tres en tres amb repetició), és obvi que alguns aminoàcids han de tenir correspondència amb diversos triplets diferents. Els triplets que codifiquen aminoàcids es denominen codons. La confirmació d'aquesta hipòtesi es deu a Nirenbert, Ochoa i Khorana. En la biosíntesi de proteïnes es poden distingir les etapes següents:
a) Activació dels aminoàcids.
b) Traducció:
- Iniciació de la síntesi.
- Elongació de la cadena polipeptídica.
- Terminació de la síntesi.
c) Associació de diverses cadenes polipeptídiques i, a vegades, de grups prostètics per a constituir les proteïnes.
La síntesi de proteïnes o traducció té lloc en els ribosomes del citoplasma cel·lular. Els aminoàcids són transportats per l'ARN de transferència (ARNt), específic per a cada un d'ells, i són portats fins a l'ARN missatger (ARNm), on s'aparellen el codó d'aquest i l'anticodó de l'ARN de transferència per complementarietat de bases i, d'aquesta forma, se situen en la posició que els correspon.
Una vegada finalitzada la síntesi d'una proteïna, l'ARN missatger queda lliure i pot ser llegit novament. De fet, és molt freqüent que abans que finalitze una proteïna ja n'està començant una altra, amb la qual cosa, una mateixa molècula d'ARN missatger està sent utilitzada per diversos ribosomes, simultàniament.
Procés de la síntesi
modificaActivació dels aminoàcids
modificaEls aminoàcids, en presència de l'enzim aminoacil-ARNt-sintetasa i d'ATP, són capaços d'unir-se a un ARNt específic i donen lloc a un aminoacil-ARNt, alliberant-se AMP, fosfat i quedant lliure l'enzim, que torna a actuar.
Iniciació de la síntesi de proteïnes
modificaÉs la primera etapa de la traducció o síntesi de proteïnes. L'ARNm s'uneix a la subunitat menor dels ribososmes. A aquests s'associa l'aminoacil-ARNt, gràcies al fet que l'ARNt té en una de les seues anses un triplet de nucleòtids denominat anticodó, que s'associa al primer triplet codó de l'ARNm, segons la complementarietat de les bases. A aquest grup de molècules s'uneix la subunitat ribosòmica major, formant-se el complex ribosòmic o complex actiu. Tots aquests processos estan catalitzats pels anomenats factors d'iniciació (FI). El primer triplet o codó que es tradueix és generalment l'AUG, que correspon amb l'aminoàcid metionina en eucariotes. En procariotes és la formilmetionina.
Elongació de la cadena polipeptídica
modificaEl complex ribosomal posseeix dos llocs d'unió o centres. El centre peptidil o centre P, on se situa el primer aminoacil-ARNt i el centre acceptor de nous aminoacil-ARNt o centre A. El radical carboxil (-COOH) de l'aminoàcid iniciat s'uneix amb el radical amina (NH2) de l'aminoàcid següent mitjançant enllaç peptídic. Aquesta unió és catalitzada per l'enzim peptidil-transferasa. El centre P queda perquè ocupat per un ARNt sense aminoàcid. L'ARNt sense aminoàcid ix del ribosoma. Es produeix la translocació ribosomal. El dipeptil-ARNt queda ara al centre P. Tot això és catalitzat pels factors d'elongació (FE) i precisa GTP. Segons la terminació de la tercera cuera, apareix el tercer aminoacil-ARNt i ocupa el centre A. Després, es forma el tripèptid en A i posteriorment el ribosoma realitza la seua segona translocació. Aquests passos es poden repetir múltiples vegades, fins a centenars de vegades, segons el nombre d'aminoàcids que continga el polipèptid.
Terminació de la síntesi de la cadena polipeptídica
modificaEl final de la síntesi ve informat pels anomenats triplets sense sentit. Són tres: UAA, UAG i UGA. No hi ha cap ARNt l'anticuera del qual siga complementari d'ells i, per tant, la biosíntesi del polipèptid s'interromp. Indiquen que la cadena polipeptídica ja ha acabat. Aquest procés ve regulat pels factors R.
Un ARNm, si és prou llarg, pot ser llegit o traduït per diversos ribosomes al mateix temps, l'un darrere de l'altre. Al microscopi electrònic s'observa com un rosari de ribosomes que es denomina polirribosoma.
Associació de diverses cadenes polipeptídiques per a constituir les proteïnes
modificaConforme es va sintetitzant la cadena polipeptídica, aquesta va adoptant una determinada estructura secundària i terciària mitjançant els enllaços per pont d'hidrogen i els enllaços disulfur, respectivament. Així, la cadena polipeptídica adquireix una configuració espacial determinada.
Després de la traducció hi ha proteïnes enzimàtiques que ja són actives i altres que precisen eliminar alguns aminoàcids per a ser-ho. Generalment, se separa l'aminoàcid metionina o aminoàcid iniciador. Alguns enzims precisen associar-se a ions o coenzims (grup prostètic) per a ser funcionals o actives.
Les proteïnes poden estar constituïdes per una cadena polipeptídica o per diverses subunitats. Les subunitats poden ser iguals o distintes, segons provinguen del mateix o de gens diferents.
El control de qualitat del plegament de les proteïnes per a adquirir l'estructura quaternària o conformació tridimensional es du a terme per xaperones i proteases. Les proteïnes xaperones tenen la funció de plegar o replegar correctament a les proteïnes acabades de sintetitzar (modificació postraduccional), i les proteases han de degradar aquelles proteïnes que, a pesar de l'acció de les xaperones, no es pleguen correctament. Quan els mecanismes de control fallen, les proteïnes danyades s'acumulen causant malalties amiloidogèniques.
Referències
modifica- ↑ Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4