Cèl·lula mare del càncer
Les cèl·lules mare del càncer o CSCs (de l'anglès Cancer Stem Cells) són la subpoblació de les cèl·lules d'un tumor que tenen la capacitat de produir teixit cancerós nou. Aquestes cèl·lules serien el motor que impulsa el creixement de cèl·lules canceroses noves, i amb tota probabilitat, l'origen del procés cancerós. Les cèl·lules mare del càncer, també conegudes com a cèl·lules iniciadores del tumor o cèl·lules tumorigèniques poden definir-se operacionalment basant-se en tres propietats distintives:[1]
- Capacitat d'iniciar un tumor i de conduir la proliferació neoplàstica.
- Capacitat de produir un nombre il·limitat de còpies de si mateixes mitjançant l'auto-renovació.
- Potencial per donar lloc a qualsevol cèl·lula dins d'un tumor mitjançant el procés de diferenciació.
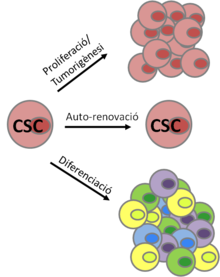
Aquestes cèl·lules iniciadores del tumor o cèl·lules tumorigèniques presenten propietats similars a les de les cèl·lules mare, com són la capacitat d'autorenovar-se i de diferenciar-se,[2] d'aquí que se les anomeni cèl·lules mare del càncer.
Les cèl·lules mare del càncer, de la mateixa manera que les cèl·lules mare normals dels teixits, són una minoria de la població cel·lular d'un tumor, però són les úniques que posseeixen la capacitat d'iniciar i liderar el creixement i la propagació del tumor. Les CSCs originen una progènie de cèl·lules canceroses que, si bé constitueixen la majoria de les cèl·lules del tumor, no contribueixen al seu manteniment, ja que són més diferenciades i estan destinades a deixar de proliferar o morir perquè tenen una capacitat limitada o nul·la de divisions mitòtiques ulteriors.
Indicis de l'existència de les CSCs
modificaUn conjunt d'observacions del comportament dels tumors va portar als investigadors a pensar que només una subpoblació minoritària de les cèl·lules tumorals eren les responsables de l'origen i del manteniment de la malaltia. Aquestes observacions són:
Heterogeneïtat de les cèl·lules d'un tumor
modificaEncara, que molts tumors s'originen de la transformació d'una única cèl·lula, no totes les cèl·lules del tumor són idèntiques entre si. De fet hi ha molts tipus de cèl·lules en un tumor. Els tumors estan organitzats jeràrquicament de manera similar als teixits normals, i per tant, estan formats per una combinació heterogènia de cèl·lules amb característiques fenotípiques diferents i amb diferents potencials proliferatius.[3][4][5]
Es pot considerar un tumor com un teixit aberrant originat per una cèl·lula tumorigènica que adquireix la capacitat de proliferar indefinidament mitjançant l'acumulació de mutacions. Les cèl·lules canceroses tumorigèniques donen lloc a una progènie diversa que presenta diferents graus de diferenciació, incloent cèl·lules canceroses amb un potencial proliferatiu il·limitat i cèl·lules canceroses amb un potencial proliferatiu limitat o nul.[6] Això suggereix que les cèl·lules canceroses tumorigèniques porten a terme un procés d'auto-renovació i diferenciació anàleg al de les cèl·lules mare normals.
Improbabilitat d'acumular mutacions en cèl·lules de vida curta
modificaSe sap que els tumors s'originen quan una acumulació d'alteracions en gens crucials per a una cèl·lula fa que aquesta adquireixi una sèrie de capacitats especials[7] que li permeten burlar els mecanismes que controlen la proliferació, els que porten a les cèl·lules anormals a suïcidar-se o els que eviten que les cèl·lules emigrin a altres teixits. Ara bé, la majoria de les cèl·lules d'un teixit tenen una vida molt curta, generalment de dies o setmanes, el que fa molt improbable que puguin acumular totes aquestes mutacions.[8]
Una possible explicació seria que les mutacions tumorigèniques es produeixin sobre cèl·lules menors en nombre però que persisteixin als teixits, com és el cas de les cèl·lules mare o bé de cèl·lules progenitores que han adquirit l'habilitat d'autorenovar-se. La mutació d'aquestes cèl·lules originaria les CSCs.
Dificultats a l'hora de reproduir un tumor
modificaLa necessitat d'injectar milions de cèl·lules canceroses a un ratolí per poder reproduir un tumor[9][10] va portar als investigadors a pensar que tan sols hi ha un nombre limitatde cèl·lules canceroses que són capaces d'originar i mantenir el tumor i que aquestes cèl·lules són minoritàries dins les poblacions de cèl·lules tumorals.
Ineficiència de la metàstasi
modificaLa metàstasi és un procés multiseqüencial: les cèl·lules canceroses abandonen el seu lloc d'origen, envaeixin un vas sanguini o limfàtic, viatgen per ell i estableixen noves colònies en llocs distants. Aquest procés és una operació complexa, lenta i poc eficient; molt poques cèl·lules ho aconsegueixen.[11] S'ha estimat que tan sols el 2% de les cèl·lules que aconsegueixen migrar a un nova localització són capaces d'iniciar el creixement tumoral. A més, menys d'un 1% de les cèl·lules que inicien el creixement de la massa tumoral a la nova localització són capaces de mantenir aquest creixement per esdevenir metàstasis macroscòpiques.[12] Una hipòtesi que explica aquesta ineficàcia suggereix que a la majoria de les cèl·lules canceroses els manca la capacitat de generar nous tumors i que és només un petit, i generalment especialitzat, subconjunt de cèl·lules canceroses el que condueix l'expansió de la malaltia cap a òrgans distants.
Reincidència d'alguns tumors
modificaUna prova més que dona suport a l'existència de CSCs prové de les observacions clíniques on sovint s'ha constatat que molts tumors responen inicialment a la quimioteràpia, però freqüentment reapareixen.[13][14] Un dels possibles motius per explicar el fracàs d'aquests tractaments és que les teràpies convencionals, enfocades a matar el major nombre possible de cèl·lules canceroses, no aconsegueixin eliminar eficaçment el petit nombre de CSCs, que serien les responsables de la regeneració del tumor.[15]
Descobriment de les CSCs
modificaL'any 1997, mitjançant la citometria de flux i el xenotrasplantament a ratolins immunodeficients, el grup del Dr. Dick va aportar els primers resultats sòlids que donaven suport a la hipòtesi de les cèl·lules mare del càncer, aïllant cèl·lules mare de la leucèmia mieloide aguda (AML). Les cèl·lules aïllades, que es trobaven en una proporció aproximada d'1:250000 cèl·lules i eren força immadures en termes de diferenciació, tenien la capacitat d'iniciar l'AML humana quan eren trasplantades a ratolins immunodeficients.[16][17]
El 2003, el Dr. Jones va identificar una població de CSCs en un mieloma múltiple. Es tracta d'una població que representa menys del 5% de totes les cèl·lules canceroses.[18]
A principis d'aquell mateix any, un grup d'investigadors de la Universitat de Michigan va publicar la primera prova de l'existència de CSCs en tumors sòlids a l'aïllar cèl·lules mare d'un tumor de mama. Només una subpoblació de cèl·lules (aproximadament el 2%) tornava a crear el tumor original en el nou entorn.[19]
El 2004, el grup encapçalat pel Dr. Dicks de la Universitat de Toronto va identificar cèl·lules procedents de tumors primaris del sistema nerviós central humà que mostraven la capacitat de regenerar la totalitat del tumor en ratolins.[20]
El 2007 investigadors de la Universitat de Michigan van identificar CSCs del càncer de pàncrees, on constitueixin entre el 0.2-0,8% de la població del tumor.[21]
També s'han identificat cèl·lules mare tumorals en càncer de pròstata,[22] de còlon,[23] de fetge[24] i de pell,[25] entre d'altres. Aquests fets confirmen que la majoria (sinó tots) els tumors són heterogenis i que només una petita part de la massa del tumor té la capacitat de mantenir, expandir i reproduir el tumor.
Possibles orígens de les CSCs
modificaLes cèl·lules mare del càncer, CSCs, poden tenir dos possibles orígens.[26] Per una banda, les CSCs poden procedir de cèl·lules mare normals que han patit mutacions oncogèniques que han inactivat els controls que restringeixen la seva l'expansió. Per l'altra, observacions recents semblen indicar que, en alguns càncers, les CSCs s'originen a partir les cèl·lules progenitores, els descendents immadurs de les cèl·lules mare, que haurien adquirit la capacitat d'autorenovar-se.
CSCs originades a partir de cèl·lules mare
modificaLes mutacions oncogèniques poden alterar la dependència de les cèl·lules mare del seu nínxol (micro-ambient especialitzat on les cèl·lules mare resideixen i que regula el seu manteniment i l'equilibri entre autorenovació i diferenciació)[27] i això pot conduir a la seva transformació en CSCs. Hi ha tres possibles mecanismes:
- Nínxol expandit: Les cèl·lules mare portadores de mutacions oncogèniques es mantindrien inicialment sota control gràcies als senyals del
- nínxol sa, fins que una alteració addicional de les cèl·lules o una alteració del nínxol produiria una expansió d'aquest últim. En un nou entorn més
- gran, s'incrementaria la població de CSCs. Aquesta població més gran de CSCs produiria cèl·lules canceroses diferenciades, no tumorigèniques, però
- encarregades de constituir la major part de la massa tumoral.
- Nínxol alternatiu: Diverses alteracions oncogèniques de les CSCs els permetrien adaptar-se a un nou nínxol i, a més, poder dominar les altres
- cèl·lules del nínxol per tal que aquestes els enviessin senyals d'auto-renovació. D'aquesta forma també augmentarien en nombre i incrementarien la
- seva capacitat de proliferació. Així aconseguirien envair els teixits dels voltants o traslladar-se fins a localitzacions distants en l'organisme
- formant les metàstasis.
- Independència del nínxol: Finalment, la tercera hipòtesi suggereix que les alteracions oncogèniques permetrien a les CSCs independitzar-se del
- nínxol. Com a resultat les cèl·lules mare anòmales s'alliberarien del control de l'entorn sobre l'auto-renovació i la proliferació. Les CSCs
- controlarien la seva pròpia auto-renovació i això donaria com a resultat la generació de tumors formats per cèl·lules mare i la seva progènie no
- tumorigènica.
CSCs originades a partir de cèl·lules progenitores
modificaMutacions en les cèl·lules progenitores[28] provocarien l'activació de l'auto-renovació, una propietat exclusiva de les cèl·lules mare; això és el que s'anomena mutació auto-renovadora. Mutacions addicionals en aquesta reserva de cèl·lules progenitores anormals podrien acabar produint la progressió cap a un estat neoplàstic.
Principals vies regulatòries de les CSCs
modificaL'estudi dels gens i proteïnes que regulen l'auto-renovació de les CSCs pot permetre desenvolupar noves estratègies terapèutiques dirigides a aquestes vies, de manera que es pugui incrementar l'eficàcia dels tractament contra el càncer i reduir el risc de recurrència i metàstasi.
Donat que les cèl·lules mare normals i les cèl·lules mare del càncer comparteixen la capacitat d'auto-renovació, és lògic suposar que les CSCs s'apropien de les vies d'auto-renovació de les cèl·lules mare normals.[29] A més, aquestes vies s'han trobat desregulades en nombrosos càncers.
Les principals vies que regulen l'auto-renovació tant de les cèl·lules mare com de les cèl·lules mare del càncer són:
Bmi-1
modificaEl gen Bmi-1 de la família de gens Polycomb és crucial per a l'auto-renovació de les cèl·lules mare hematopoètiques (HSCs)[30] i de les cèl·lules mare del sistema nerviós central i perifèric.[31]
El gen té un important paper en diversos tipus de càncers humans incloent el càncer de pulmó, ovari, mama i medul·loblastoma.[32] També s'ha demostrat que és essencial per a l'auto-renovació de les cèl·lules mare de la leucèmia.[33] El gen Bmi-1 està sobre-expressat a la leucèmia mieloide aguda (AML).[34] Aquestes dades semblen indicar que Bmi-1 pot exercir un important paper en la iniciació i progressió del càncer.
Sonic Hedgehog
modificaLa via del Sonic Hedgehog (Shh) realitza diverses funcions crítiques durant el desenvolupament embrionari i està implicada en el desenvolupament postnatal i adult del cervell.[35] En els organismes adults, aquesta via de senyalització té un paper fonamental en el control del comportament de les cèl·lules mare i de les cèl·lules progenitores.[36]
Mutacions del Shh causen la síndrome de Gorlin. Una senyalització inadequada d'aquesta via sembla estar involucrada en la carcinogènesi de la pell i del cervell,[37] incloent el carcinoma de cèl·lules basals de la pell i el medul·loblastoma.
Un augment de la senyalització d'aquesta via sembla estar associada a una expansió de les CSCs, que poden provenir tant de cèl·lules mare com de cèl·lules progenitores que adquireixen les característiques de les CSCs. Els estudis de diferents tipus de càncer, en especial del medul·loblastoma, mostren com es pot originar un tumor a partir de cèl·lules mare o progenitores com a resposta a una senyalització persistent de la via Shh.
Notch
modificaLa via Notch juga un important paper en el control de la proliferació de les cèl·lules mare hematopoètiques (HSCs), neuronals[38] i mamàries.[39]
La cascada de senyalització Notch es troba desregulada en diversos tipus de càncers. Una activació aberrant d'aquesta via de senyalització causa la leucèmia limfoblàstica aguda de les cèl·lules T (T-ALL).[40]
Wnt/ß-catenina
modificaLa via WNT/ß-catenina és essencial per al manteniment del nínxol de les cèl·lules mare en diferents òrgans a la vegada que regula la diferenciació cel·lular. Aquesta via està involucrada en l'auto-renovació de les cèl·lules mare hematopoètiques (HSCs),[41] en el manteniment de les cèl·lules epitelials de l'intestí i en les respostes regeneratives durant la reparació dels teixits.
Però aquesta via també té un paper important en el carcinoma de còlon[42] i en la leucèmia mieloide crònica (CML). Les mutacions del gen ß-catenina són comunes en el càncer colorectal i s'ha observat que la ß-catenina s'acumula a les cèl·lules dels progenitors de granulòcits-macròfags quan la CML progressa cap a la crisi blàstica,[43] mostrant que hi ha mecanismes moleculars que poden transformar les cèl·lules progenitores en cèl·lules mare de la leucèmia.
L'acumulació de la ß-catenina també s'ha associat als càncers de mama, als melanomes, als sarcomes, a les leucèmies mieloides, als mielomes múltiples i als tumors cerebrals.[29] També s'han observat mutacions del gen ß-catenina en carcinomes endometrials, de pròstata i hepatocel·lulars.[44]
Hox
modificaLa família de gens Hox és important en l'hematopoesi normal i maligna. Gens de la família Hox estan implicats en leucèmies humanes, com l'AML i la T-ALL. Estudis realitzats en ratolins, mostren que la sobre-expressió d'aquests gens, com per exemple el HoxB6, produeix AML després d'aproximadament sis mesos, suggerint que els gens responsables de la proliferació de les cèl·lules mare estan directament involucrats en la iniciació de l'AML.[45][46]
PTEN
modificaLa via PTEN està implicada en el manteniment de les cèl·lules mare hematopoètiques i neuronals.
La pèrdua de la funció del PTEN condueix al desenvolupament de glioblastoma multiforme, carcinoma de pròstata o d'endometri.[47]
Aïllament i caracterització de les CSCs
modificaMètodes d'aïllament
modificaEls tres mètodes més utilitzats inclouen:
- Aïllament per citometria de flux fent servir l'habilitat d'aquestes cèl·lules per excloure tints fluorescents.
- Aïllament mitjançant citrometria de flux fent servir marcadors específics de membrana.
- Cultiu d'esferes.
Exclusió de tints fluorescents
modificaLes CSCs, igual que les cèl·lules mare, tenen la propietat d'excloure tints fluorescents com el Hoechst 3342 o la rodamina 123 gràcies als alts nivells de proteïnes transportadores ABC que presenten (que bombegen de forma activa el marcador cap a l'exterior de la cèl·lula). Quan una suspensió de cèl·lules tumorals tractada amb el fluorocrom es fa passar per un citòmetre de flux (FACS), es troba una subpoblació que forma una petita cua lateral (SP de l'anglès side population) menys fluorescent adjacent a la població majoritària de cèl·lules que sí que acumula tint i presenta una alta intensitat de fluorescència. Aquesta SP conté sinó totes, la majoria de cèl·lules capaces d'originar nous càncers en ser trasplantades a ratolins immunodeficients. Les SPs són riques en cèl·lules amb propietats de CSCs, ja que tenen una elevada capacitat tumorigènica, expressen gens de cèl·lules mares i tenen capacitat d'auto-renovació.
Aquest mètode d'identificació i aïllament s'ha utilitzat per l'obtenció de poblacions enriquides de CSCs de diversos tipus de càncers com: la leucèmia, els càncers d'ovari,[48] cervell,[49] pulmó,[50] tiroides,[51] pròstata, mama[52] i dels carcinomes hepatocel·lular[53] i naseofaríngic,[54] entre d'altres.
Marcadors de membrana
modificaEl mètode es basa en el marcatge de cèl·lules amb un o més anticossos de proteïnes (antígens) de membrana específiques d'aquestes cèl·lules. Els anticossos s'uneixen als antígens i a la vegada estan lligats a molècules fluorescents.
Aquest fet permet que les cèl·lules que presenten aquestes proteïnes de membrana siguin aïllades per FACS. D'aquesta manera s'aïllen subpoblacions caracteritzades per la presència o absència d'un marcador o conjunt de marcadors en les membranes de les cèl·lules.
D'aquesta manera es van aïllar, entre d'altres: cèl·lules mare de l'AML (leucèmia mieloide aguda)[16] caracteritzades amb el fenotip CD34+CD38- (indicant la presència de proteïnes CD34 i l'absència de proteïnes CD38 de la seva superfície); cèl·lules mare del mieloma múltiple[18] caracteritzades amb el fenotip CD138-; del càncer de mama,[19] definides pel fenotip CD44+CD24-; de tumors cerebrals (glioblastomes i medul·loblastomes),[20] amb fenotip CD133+.
Recentment, s'han fet descobriments similars pels càncers de còlon,[23] pàncrees[21] i carcinoma escatós de coll i cap[55] entre d'altres.
Formació d'esferes
modificaLes CSCs també poden aïllar-se gràcies a la seva habilitat per formar per formar agregats cel·lulars esfèrics en condicions de cultiu no adherents.
Aquest fet va ser observat per primera vegada en les cèl·lules mare del sistema nerviós central.[55] Posteriorment es va demostrar que un subconjunt de cèl·lules procedents de tumors del sistema nerviós central presentaven també l'habilitat de formar neuroesferes.[56]
L'habilitat de les CSCs per formar esferes s'ha observat també en els càncers de mama,[57] pròstata,[58] còlon,[59] pàncrees i en melanomes.
Encara que el cultiu d'esferes és el mètode més senzill per aconseguir poblacions riques en CSCs (comparativament amb els dos procediments anteriors), també presenta limitacions. Segurament el principal desavantatge és que les esferes no representen una població homogènia, només una part de les cèl·lules són capaces d'autorenovar-se.
Caracterització
modificaUna vegada aïllades les CSCs per qualsevol dels mètodes descrits anteriorment, cal verificar si la subpoblació cel·lular obtinguda està formada realment per CSCs. Per això s'ha de comprovar experimentalment si aquestes cèl·lules presenten les característiques d'auto-renovació, tumorigènesi i capacitat de reproduir el tumor original, pròpies de les CSCs.
De fet, el 2006, la American Association for Cancer Research va concloure que les CSCs tan sols es poden definir experimentalment per la seva capacitat de recapitular la formació d'un tumor en continu creixement.[1]
Comprovació de la tumorigènesi
modificaUna de les proves per demostrar que una subpoblació cel·lular d'un tumor és realment de CSCs consisteix a comprovar la seva habilitat per formar tumors a baixes densitats cel·lulars. Per això s'injecta un nombre reduït d'aquestes cèl·lules a un ratolí immunodeficients (el ratolí nu o el ratolí NOD/SCID) i es comprova si són capaces d'originar i mantenir un tumor.[60]
Comprovació de l'auto-renovació
modificaUna altra característica que han de tenir les subpoblacions de cèl·lules aïllades d'un tumor per ser considerades CSCs és la capacitat d'auto-renovació.
L'auto-renovació es pot comprovar per dos mètodes:[59]
- In vivo, mitjançant trasplantaments en sèrie: una vegada aïllades les cèl·lules que suposadament són CSCs, es trasplanten a un ratolí
- immunodeficient. Un cop s'hagi originat el tumor, s'extirpa i de nou es tornen a aïllar les cèl·lules amb el possible fenotip de CSCs, que novament
- són trasplantades per veure si tornen a originar el tumor.
- In vitro, mitjançant l'habilitat de les CSCs de formar esferes al llarg de múltiples generacions. Consisteix a formar agregats cel·lulars
- esfèrics, dissociar-los, i tornar-los a plantar per poder determinar l'habilitat de les cèl·lules per formar noves esferes.
Establiment de l'heterogeneïtat del tumor
modificaLes CSCs no només han de ser capaces d'autorenovar-se, sinó que també han de poder diferenciar-se i reproduir l'heterogeneïtat vista en els tumors. Existeixen dues maneres de comprovar si la subpoblació de suposades CSCs aïllada té la capacitat de diferenciar-se. Un dels mètodes consisteix a examinar l'heterogeneïtat dels tumors derivats d'aquestes CSCs, i l'altre en determinar l'habilitat de les CSCs per diferenciar-se in vitro.
- In vivo: l'heterogeneïtat dels tumors derivats de CSCs es pot comprovar per citometria de flux amb marcadors de membrana. En ser xenotrasplantades
- les CSCs originen fenocòpies del tumor original després d'un segon i tercer trasplantament. Els nous tumors contenen una població heterogènia amb una
- minoria de cèl·lules tumorigèniques i una majoria de cèl·lules no tumorigèniques.[19]
- In vitro: les CSCs en cultiu es diferencien tant en presència com en absència de factors que indueixen la diferenciació. Les cèl·lules
- diferenciades in vitro perden els marcadors de membrana propis de les CSCs i el potencial tumorigènic.
Implicacions terapèutiques de les CSCs
modificaL'evidència que molts càncers són originats i mantinguts per CSCs té importants implicacions clíniques. Els tractaments convencionals operen sota el supòsit que totes les cèl·lules canceroses tenen el mateix potencial maligne i, per tant, manquen d'especificitat contra les CSCs. Molts d'aquests tractaments redueixen la mida dels tumors, però sovint no eliminen les CSCs, fet que produeix la recurrència del tumor.
Resistència de les CSCs a teràpies convencionals
modificaL'efectivitat de les teràpies convencionals per guarir el càncer es veu freqüentment afectada per la resistència d'alguns tumors, bé sigui intrínseca o adquirida, als agents citotòxics i a la radiació ionitzant.
Les cèl·lules mare normals són relativament quiescents, és a dir, proliferen infreqüentment. A més, també es coneix que les cèl·lules mare normals són molt més resistents a les toxines i a la radiació que les cèl·lules més madures del mateix teixit. Els mecanismes cel·lulars implicats en aquesta resistència inclouen una major activació de la capacitat de reparar els danys del DNA, de les vies que inhibeixen l'apoptosi i de les proteïnes transportadores ABC, que produeixen fluxos de sortida de drogues que eviten l'acumulació d'agents citotòxics a la cèl·lula.
Si les CSCs comparteixen moltes de les propietats de les cèl·lules mare, sembla lògic pensar que la quimioteràpia i radioteràpia convencionals, que actuen principalment sobre cèl·lules amb ràpida proliferació, poden matar la progènie de les CSCs, però és molt probable que no afectin a les CSCs, ja que són força quiescents. A més, la presència dels mecanismes de reparació del DNA,[61] d'una major expressió de proteïnes antiapoptòtiques Bcl-2 i dels fluxos de sortida de drogues,[62] les conferirien una resistència addicional a aquests tipus de teràpies.
Teràpies dirigides contra les CSCs
modificaSi les CSCs són les culpables de la iniciació i la progressió dels tumors, els tractaments contra el càncer dirigits contra les CSCs podrien incrementar l'eficàcia de les teràpies i reduir el risc de recurrència i de disseminació.[63]
Les estratègies de tractament poden estar dirigides a:[64]
- l'eliminació de CSCs fent servir immunoteràpia, petites molècules o virus oncolítics.
- el bloqueig de mecanismes preferencialment operatius en CSCs.
- la reversió de la resistència de les CSCs a la quimioteràpia i la radioteràpia.
- la inducció de la diferenciació de les CSCs.
Vegeu també
modificaReferències
modifica- ↑ 1,0 1,1 Clarke MF, Dick JE, Dirks PB, Eaves CJ, Jamieson CHM., Jones DL et al. Cancer Stem Cells-Perspectives on Current Status and Future Directions: AACC Workshop on Cancer Stem Cells. Cancer Research. 2006; 66 (19): 9339-9344
- ↑ Dick JE. Stem cell concepts renew cancer research. Blood. 2008; 112 (13): 4793– 4807
- ↑ Park CH, Bergsagel DE, McCulloch EA. Mouse myeloma tumor stem cells: a primary cell culture assay. J. Natl. Cancer Inst. 1971; 46: 411-22
- ↑ Fidler IJ, Hart IR. Biological diversity in metastatic neoplasms: origins and implications. Science. 1982; 197: 893-95
- ↑ Heppner GH. Tumor heterogeneity. Cancer Res. 1984; 44: 2259-72
- ↑ Reya T, Morrison SJ, Clarke MF, Weissman, IL. Stem cells, cancer and cancer stem cells. Nature. 2001; 414: 105-11
- ↑ Hanahan D, Weinberg RA. The Hallmarks of Cancer. Cell. 2000; 100: 57-70
- ↑ Bomsn BM, Wicha MS. Cancer Stem Cells: A Step Toward the Cure. Journal of Clinical Oncology. 2008;26 (17):2795-98
- ↑ Hamburger AW, Salmon SE. Primary bioassays of human tumor stem cells. Science. 1977; 197: 461-63
- ↑ Bruce WR, Van Der Gaag H. A quantitative assay for the number of murine lymphoma cells capable of proliferation in vivo. Nature. 1963; 199:79-80
- ↑ Weiss L. Metastatic innefficiency. Adv. Cancer Res. 1990; 54: 159-211
- ↑ Luzzi KJ, Macdonald IC, Schmidt EE, Kerkvliet N, Morris VL, Chambers AF, Groom AC. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. The American journal of pathology. 1998; 153 (3): 865-73
- ↑ Gottesman MM, Fojo T, Bates SE. Multidrug resistance in cancer: role of ATP-dependent transporters. Nat Rev Cancer. 2002; 2: 48-58
- ↑ Liu G, Black KL, Yu JS. Sensitization of malignant glioma to chemotherapy through dendritic cell vaccination. Expert Review of Vaccines. 2006; 5: 233-247
- ↑ Hambardzumyan D, Squatrito M, Holland ED, Radiation resistance and stem-like cells in brain tumors. Cancer Cell. 2006; 10: 454-456
- ↑ 16,0 16,1 Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 1997; 3: 730-37
- ↑ Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994; 17: 645-48
- ↑ 18,0 18,1 Matsui W, Huff CA, Wang Q, Malehorn T, Barber J, Tanhehco Y, Smith BD, Cwin CI, Jones RJ. Characterization of clonogenic multiple myeloma cells. Blood. 2004; 103 (6): 2332-2336
- ↑ 19,0 19,1 19,2 Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. USA. 2003; 100: 3983-88
- ↑ 20,0 20,1 Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, et al. Identification of human brain tumor initiating cells. Nature. 2004; 432: 396-401
- ↑ 21,0 21,1 Li C, Heidt DG, Dalerva P, burant CF, Adsay V, Wicha M Clarke MF, Simeone DM. Identification of pancreatic cancer stem cell. Cancer Res. 2007; 67 (3): 1030-1037
- ↑ Collins AT, Berry Pa, Hyde C, Stowe MJ, Maitland MJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005; 65: 10946-10951
- ↑ 23,0 23,1 Dalerba P, Dylla SJ, Park IK, Liu R, Wang X, Cho RW, et al. 2007. Phenotypic characterization of huma colorectal cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 2007; 104: 973-978
- ↑ Sel S, Leffert HL. Liver cancer stem cells. J. Clin. Oncol. 2008; 26: 2800-2805
- ↑ Fang D, Nguyen TK, Leishear K, Finko R, Kulp AN, Hotz S, Van Belle PA, Xu X, Elder DE, Herlyn M. A tumorigenic subpopulation with stem cell properties in melanomas. Cancer res. 2005; 65: 9328-9337
- ↑ Clarke, MF, Fuller, M. Stem Cells and Cancer: Two faces of Eve. Cell. 2006; 124 (6): 1111-15
- ↑ Spradling A, Drummond-Barbosa D, Kai T. Stem cells find their niche. Nature. 2001; 414: 98-104
- ↑ Krivtsov AV, Twomey D, Feng Z, Stubbs MC, Wang Y, et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 2006; 442:818-822
- ↑ 29,0 29,1 Lobo, NA, Shimono, Y, Qian, D, Clarke, MF. The Biology of Cancer Stem Cells. Annu. Rev. Cell Dev. Biol. 2007; 23: 675-99
- ↑ Park IK, Qian D, Kiel M, Becker MW, Pihalja M, Weissman IL, et al. Bmi-1 is required for maintenance of adult self-renewing haematopoietic stem cells. Nature. 2003; 423: 302-305
- ↑ Molofsky AV, Pardal R, Iwashita T, Park IK, Clarke MF, Morrison SJ. BMi-1 dependence distinguishes neural stem cell self-renewal from progenitor proliferation. Nature. 2003; 425: 926-967
- ↑ Leung C, Lingbek P, Lohuizen M, Marino S. Bmi-1 is esential for cerbellar development and is overexpresed in human medulloblastomas. Nature. 2004; 428: 337-341
- ↑ Lessard J, Sauvageau G. Bmi-1 determines the proliferative capacity of normal and leukaemic stem cells. Nature. 2003; 423:255-60
- ↑ Sawa M, Yamamoto K, Yokozowa T, Kiyoi H, Hishida A, et al. Bmi-1 is highly expressed in M0-subtype acute myeloid leukemia. Int. J. Hematol. 2005; 82: 42-47
- ↑ Palma V, Lim DA, Dahmane N, Sanchez P Brionne TC, et al. Sonic hedgehog controls stem cell behavior in the postnatal and adult brain. Development. 2005; 132: 335-344
- ↑ Wechsler-Reya RJ, Scott MP. Control of neuronal precursor proliferation in the cerebellum by Sonic Hedgehog. Neuron. 1999; 22 (1): 103-114
- ↑ Ruiz i Altaba A, Sánchez P, Dahmane N. Gli and hedgehog in cancer: tumours, embryos and stem cells. Nat. Rev. Cancer. 2002; 2: 361-372
- ↑ Androutsellis-Theotokis A, Leker RR, Solder F, Hoeppner DJ, Ravin R, et al. Notch signalling regulates cell number in vitro and in vivo. Nature. 2006; 442: 823-826
- ↑ Dontu G, Jackson KW, McNicholas E, Kawamura MJ, Abdallah WM, Wicha MS. Role of Notch signaling in cell-fate determination of human mammary stem/progenitor cells. Breast Cancer Res. 2004; 6: R604-R615
- ↑ Ellisen LW, Bird J, West DC, Soreng AL, Reynolds TC, Smith SD,Sklar J. TAN-1, the human homolog of the Drosophila notch gene, is broken by chromosomal translocations in T lymphoblastic neoplasms. Cell. 1991; 66: 649-661
- ↑ Reya T, Duncan AW, Ailles L, Domen J, Scherer DC, et al. A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature. 2003;423:409-414
- ↑ Kollings FT, HU G, Dang CV, Fearon ER. Neoplastic transformation of RK3E by mutant ß-catenin requires deregulation of Tcf/Lef transcription but not activation of c-myc expression. Mol. Cell. Biol. 1999; 19: 5696-5706
- ↑ Jamieson CH, Ailles LE, Dylla SJ, Muijtjens M, Jones C, et al. Granulocyte-macrophage progenitors as candidate leukemic stem cells in blast-crisis CML. N. Engl. J. Med. 2004; 351: 657-667
- ↑ Reguart N, He B, Taron M, You L, Jablons DM, Rosell R. The role of Wnt signaling in cancer and stem cells. Fut. Oncol. 2005;1: 787-97
- ↑ Fischbach NA, Rozenfeld S, Shen W, Fong S, Chrobak D, et al. HOXB6 overexpression in murine bone marrow immortalizes a myelomonocytic precursor in vitro and causes hematopoietic stem cell expansion and acute myeloid leukemia in vivo. Blood. 2995; 105: 1456-1466
- ↑ Huntly BJ, Gilliland DG. Leukaemia stem cells and the evolution of cancer-stem-cell research. Nat. Rev. Cancer. 2005; 5: 311-321
- ↑ Chow LM, Baker SJ. PTEN function in normal and neoplastic growth. Cancer Lett. 2006; 241: 186-94
- ↑ Szotek PP,Pieretti-Vanmarcke R, Masiakos PT, Dinulescu DM, Connolly D, Foster R, et al. Ovarian cancer side population defines cells with stem cell-like characteristics and Mullerian Inhibiting Substance responsiveness. Proc Natl Acad Sci U S A. 2006; 103(30): 11154–11159
- ↑ Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proceedings of the National Academy of Sciences of the United States of America. 2004; 101: 240-251
- ↑ Ho MM, Ng AV, Lam S, Hung JY. Side Population in Human Lung Cancer Cell Lines and Tumors Is Enriched with Stem-like Cancer Cells. Cancer Res.2007; 67: 4827
- ↑ Mitsutake N, Iwao A, Nagai K, Namba H, Ohtsuru A, Saenko V, et al. Characterization of side population in tyroid cancer cell lines: cancer stem-like cells are enriched partly but not exclusively. Endocrinology. 2007; 148: 1797-1803
- ↑ Alvi AJ, Clayton H, Joshi Ch, Enver T, Ashworth A, Vivanco MM, Dale TC, Smalley MJ. Functional and molecular characterisation of mammary side population cell. Breast Cancer Res. 2003; 5:R1-R8
- ↑ Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, et al. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell–like properties. Hepatopogy. 2006; 44: 240-251
- ↑ Wang J, Guo LP, Chen LZ, Zeng YX, Lu SH. Identification of Cancer Stem Cell–Like Side Population Cells in Human Nasopharyngeal Carcinoma Cell Line. Cancer Res. 2007; 67: 3716-3724
- ↑ 55,0 55,1 Prince ME, Sivanandan R, Kaczorowski A, Wolf GT, Kaplan MJ, Dalerba P, Weissman IL, Clarke MF, Ailles LE. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc Natl Acad Sci U S A.2007;104(3): 973–978
- ↑ Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB. Identification of a Cancer Stem Cell in Human Brain Tumors. Cancer Res. 2003; 63: 5821-5828
- ↑ Ponti D, Costa A, Zaffaroni N, Pratesi G, Petrangolini G, Coradini D, Pilotti S, Pierotti MA, Daidone MG. Isolation and In vitro Propagation of Tumorigenic Breast Cancer Cells with Stem/Progenitor Cell Properties. Cancer Res. 2005; 65: 5506
- ↑ Patrawala L, Calhoun T, Schneider-Broussard R, Li H, Bhatia B, Tang S, Reilly JG,Chandra D, Zhou J, Claypool K, Coghlan L, Tang DG. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 2006; 25: 1696–1708
- ↑ 59,0 59,1 Ricci-Vitiani L, Lombardi DG, Pilozzi E, Biffoni M, Todaro M, Peschle C, De Maria R. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445 :111-115
- ↑ O’Brien CA, Pollet A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007; 445: 106-110
- ↑ Bao S, Wu Q, McLendon RE, Hao Y, Shi Q, et al. Glioma stem cell promote radioresistance by preferntial activatio of the DNA damage response. Nature. 2006; 444: 756-760
- ↑ Dean M, Fojo T, Bates S. Tumor stem cells and drug resistence. Nat. Rev. Cancer. 2005; 5: 275-284
- ↑ Tang C, Ang BT, Pervaiz S. Cancer stem cell: target for anti-cancer therapy. The FASER Journal. 2007; 3: 3777-3783
- ↑ Schatton T, Frank NY, Frank MH. Identification and targeting of cancer stem cells. Bioessays. 2009; 31(10): 1038-1049