Calnexina
La calnexina (CNX) és una proteïna integral de 90KDa del reticle endoplasmàtic (ER). Consisteix en un N-terminal llarg de 50 kDa unit per calci al lumen proteic i una única cua àcida hèlix transmembrana curta (de 90 residus).[5]
Funció
modificaLa calnexina és una xaperona caracteritzada per les seves funcions principal de plegament de proteïnes i control d'aquest, assegurant-se que només les proteïnes correctament plegades puguin seguir la via de secreció.[6] La funció de la calnexina és retenir les proteïnes que no s'han plegat o no s'han glicosilat al reticle endoplasmàtic.
La calnexina actua només amb les proteïnes que tenen a l'extrem amino N-glicopreoteïnes que tenen GlcNAc2Man9Glc1 oligosacàrids.[7] Aquests oligosacàrids monoglucosilats resulten de la retallada de dos residus de glucosa per l'acció seqüencial de dues glucosidases, I i II. La glucosidasa II també pot eliminar el tercer i últim residu de glucosa. Si la glicoproteïna no es plega correctament, un enzim anomenat UGGT (per a UDP-glucosa:glicoproteïna glucosiltransferasa) afegirà el residu de glucosa de nou a l'oligosacàrid regenerant així la capacitat de la glicoproteïna d'unir-se a la calnexina.[8] Així, la cadena de glicoproteïnes plegada incorrectament es mou a l'ER i l'expressió d'EDEM/Htm1p [8][9][10] que finalment condemna la glicoproteïna de baix rendiment a la degradació eliminant un dels nou residus de mannosa. La lectina manosa Yos-9 (OS-9 en humans) marca i classifica les glicoproteïnes mal plegades per a la seva degradació. Yos-9 reconeix els residus de manosa exposats després de l'eliminació de l'α-mannosidasa d'una manosa externa de glicoproteïnes plegades malament.[11]
La calnexina s'associa amb l'enzim de plegament de proteïnes ERp57[12] per catalitzar la formació d'enllaços disulfur específics de la glicoproteïna i també funciona com a chaperona per al plegament de la cadena α del MHC de classe I a la membrana de l'ER. A mesura que les cadenes α del MHC de classe I recentment sintetitzades entren al reticle endoplasmàtic, la calnexina s'uneix a elles conservant-les en un estat parcialment plegada.[13]
Després que la β2-microglobulina s'uneix al complex de càrrega de pèptids (PLC) de la classe I del MHC, la calreticulina i l'ERp57 es fan càrrec de la tasca de chaperonar la proteïna MHC de classe I mentre que la tapasina enllaça el complex amb el transportador associat al complex de processament d'antígens (TAP). Aquesta associació prepara el MHC de classe I per unir un antigen per a la seva presentació a la superfície cel·lular.
Una associació prolongada de calnexina amb PMP22 mutant mal plegat que se sap que causa la malaltia de Charcot-Marie-Tooth[14] condueix al segrest, la degradació i la incapacitat de PMP22 per circular a la superfície cel·lular de Schwann per a la mielinització. Després de repetides rondes d'unió a la calnexina, el PMP22 mutant és modificat per la ubiquitina per a la seva degradació pel proteasoma, així com una via de recuperació de Golgi a ER per retornar qualsevol PMP22 mal plegat que va escapar de l'ER a l'aparell de Golgi.[15]
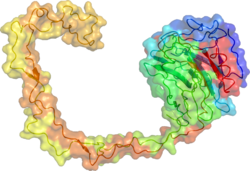
L'estructura cristal·lina de raigs X de la calnexina va revelar un domini de lectina globular i un llarg braç hidrofòbic que s'estenia cap a fora.[16]
Cofactors
modificaL'ATP i els ions de calci són cofactors implicats en la unió al substrat de la calnexina.[17]
Referències
modifica- ↑ 1,0 1,1 1,2 ENSG00000127022 GRCh38: Ensembl release 89: ENSG00000283777, ENSG00000127022 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000020368 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «SSR alpha and associated calnexin are major calcium binding proteins of the endoplasmic reticulum membrane». J Biol Chem, 226, 29, 1991, pàg. 19599–610. DOI: 10.1016/S0021-9258(18)55036-5. PMID: 1918067.
- ↑ «Association of folding intermediates of glycoproteins». Nature, 364, 644, 1993, pàg. 771–6. DOI: 10.1038/364771a0. PMID: 8102790.
- ↑ «Role of N-linked oligosaccharide recognition, glucose trimming, and calnexin in glycoprotein folding and quality control». Proc Natl Acad Sci USA, 91, 3, 1984, pàg. 913–7. DOI: 10.1073/pnas.91.3.913. PMC: 521423. PMID: 8302866.
- ↑ «Htm1p, a mannosidase-like protein, is involved in glycoprotein degradation in yeast». EMBO Rep, 2, 5, 2001, pàg. 423–30. DOI: 10.1093/embo-reports/kve089. PMC: 1083883. PMID: 11375935.
- ↑ «A novel ER alpha-mannosidase-like protein accelerates ER-associated degradation». EMBO Rep, 2, 5, 2001, pàg. 415–2. DOI: 10.1093/embo-reports/kve084. PMC: 1083879. PMID: 11375934.
- ↑ «XBP-1 regulates a subset of endoplasmic reticulum chaperone genes in the unfolded protein response». Mol Cell Biol, 23, 21, 2003, pàg. 5448–59. DOI: 10.1128/mcb.23.21.7448-7459.2003. PMC: 207643. PMID: 14559994.
- ↑ «Defining the glycan destruction signal for endoplasmic reticulum-associated degradation». Mol Cell, 32, 6, 2008, pàg. 870–7. DOI: 10.1016/j.molcel.2008.11.017. PMC: 2873636. PMID: 19111666.
- ↑ «Enhanced catalysis of ribonuclease B folding by the interaction of calnexin or calreticulin with ERp57». J Biol Chem, 273, 211, 1998, pàg. 6009–12. DOI: 10.1074/jbc.273.11.6009. PMID: 9497314.
- ↑ «Calnexin: a membrane-bound chaperone of the endoplasmic reticulum». Trends Biochem Sci, 19, 3, 1994, pàg. 124–8. DOI: 10.1016/0968-0004(94)90205-4. PMID: 8203019.
- ↑ «Association of calnexin with mutant peripheral myelin protein-22 ex vivo: a basis for "gain-of-function" ER diseases». Proc Natl Acad Sci USA, 99, 15, 2002, pàg. 9852–7. Bibcode: 2002PNAS...99.9852D. DOI: 10.1073/pnas.152621799. PMC: 125041. PMID: 12119418.
- ↑ «Rer1 and calnexin regulate endoplasmic reticulum retention of a peripheral myelin protein 22 mutant that causes type 1A Charcot-Marie-Tooth disease». Sci Rep, 4, 2014, pàg. 1–11. Bibcode: 2014NatSR...4E6992H. DOI: 10.1038/srep06992. PMC: 4227013. PMID: 25385046.
- ↑ «The structure of calnexin, an ER chaperone involved in quality control of protein folding». Mol Cell, 8, 3, 2001, pàg. 633–44. DOI: 10.1016/s1097-2765(01)00318-5. PMID: 11583625.
- ↑ «Conformational changes induced in the endoplasmic reticulum luminal domain of calnexin by Mg-ATP and Ca2+». J Biol Chem, 270, 30, 1995, pàg. 18051–9. DOI: 10.1074/jbc.270.30.18051. PMID: 7629114.
Bibliografia
modifica- Kleizen B, Braakman I «Protein folding and quality control in the endoplasmic reticulum.». Curr. Opin. Cell Biol., 16, 4, 2005, pàg. 343–9. DOI: 10.1016/j.ceb.2004.06.012. PMID: 15261665.
- Rasmussen HH, van Damme J, Puype M, et al. «Microsequences of 145 proteins recorded in the two-dimensional gel protein database of normal human epidermal keratinocytes.». Electrophoresis, 13, 12, 1993, pàg. 960–9. DOI: 10.1002/elps.11501301199. PMID: 1286667.
- Galvin K, Krishna S, Ponchel F, et al. «The major histocompatibility complex class I antigen-binding protein p88 is the product of the calnexin gene.». Proc. Natl. Acad. Sci. U.S.A., 89, 18, 1992, pàg. 8452–6. DOI: 10.1073/pnas.89.18.8452. PMID: 1326756.
- Pind S, Riordan JR, Williams DB «Participation of the endoplasmic reticulum chaperone calnexin (p88, IP90) in the biogenesis of the cystic fibrosis transmembrane conductance regulator.». J. Biol. Chem., 269, 17, 1994, pàg. 12784–8. PMID: 7513695.
- Honoré B, Rasmussen HH, Celis A, et al. «The molecular chaperones HSP28, GRP78, endoplasmin, and calnexin exhibit strikingly different levels in quiescent keratinocytes as compared to their proliferating normal and transformed counterparts: cDNA cloning and expression of calnexin.». Electrophoresis, 15, 3-4, 1994, pàg. 482–90. DOI: 10.1002/elps.1150150166. PMID: 8055875.
- Tjoelker LW, Seyfried CE, Eddy RL, et al. «Human, mouse, and rat calnexin cDNA cloning: identification of potential calcium binding motifs and gene localization to human chromosome 5.». Biochemistry, 33, 11, 1994, pàg. 3229–36. DOI: 10.1021/bi00177a013. PMID: 8136357.
- Lenter M, Vestweber D «The integrin chains beta 1 and alpha 6 associate with the chaperone calnexin prior to integrin assembly.». J. Biol. Chem., 269, 16, 1994, pàg. 12263–8. PMID: 8163531.
- Rajagopalan S, Xu Y, Brenner MB «Retention of unassembled components of integral membrane proteins by calnexin.». Science, 263, 5145, 1994, pàg. 387–90. DOI: 10.1126/science.8278814. PMID: 8278814.
- David V, Hochstenbach F, Rajagopalan S, Brenner MB «Interaction with newly synthesized and retained proteins in the endoplasmic reticulum suggests a chaperone function for human integral membrane protein IP90 (calnexin).». J. Biol. Chem., 268, 13, 1993, pàg. 9585–92. PMID: 8486646.
- Bellovino D, Morimoto T, Tosetti F, Gaetani S «Retinol binding protein and transthyretin are secreted as a complex formed in the endoplasmic reticulum in HepG2 human hepatocarcinoma cells.». Exp. Cell Res., 222, 1, 1996, pàg. 77–83. DOI: 10.1006/excr.1996.0010. PMID: 8549676.
- Otteken A, Moss B «Calreticulin interacts with newly synthesized human immunodeficiency virus type 1 envelope glycoprotein, suggesting a chaperone function similar to that of calnexin.». J. Biol. Chem., 271, 1, 1996, pàg. 97–103. DOI: 10.1074/jbc.271.1.97. PMID: 8550632.
- Devergne O, Hummel M, Koeppen H, et al. «A novel interleukin-12 p40-related protein induced by latent Epstein-Barr virus infection in B lymphocytes.». J. Virol., 70, 2, 1996, pàg. 1143–53. PMID: 8551575.
- Andersson B, Wentland MA, Ricafrente JY, et al. «A "double adaptor" method for improved shotgun library construction.». Anal. Biochem., 236, 1, 1996, pàg. 107–13. DOI: 10.1006/abio.1996.0138. PMID: 8619474.
- van Leeuwen JE, Kearse KP «Calnexin associates exclusively with individual CD3 delta and T cell antigen receptor (TCR) alpha proteins containing incompletely trimmed glycans that are not assembled into multisubunit TCR complexes.». J. Biol. Chem., 271, 16, 1996, pàg. 9660–5. DOI: 10.1074/jbc.271.16.9660. PMID: 8621641.
- Oliver JD, Hresko RC, Mueckler M, High S «The glut 1 glucose transporter interacts with calnexin and calreticulin.». J. Biol. Chem., 271, 23, 1996, pàg. 13691–6. DOI: 10.1074/jbc.271.23.13691. PMID: 8662691.
- Li Y, Bergeron JJ, Luo L, et al. «Effects of inefficient cleavage of the signal sequence of HIV-1 gp 120 on its association with calnexin, folding, and intracellular transport.». Proc. Natl. Acad. Sci. U.S.A., 93, 18, 1996, pàg. 9606–11. DOI: 10.1073/pnas.93.18.9606. PMID: 8790377.
- Trombetta ES, Simons JF, Helenius A «Endoplasmic reticulum glucosidase II is composed of a catalytic subunit, conserved from yeast to mammals, and a tightly bound noncatalytic HDEL-containing subunit.». J. Biol. Chem., 271, 44, 1996, pàg. 27509–16. DOI: 10.1074/jbc.271.44.27509. PMID: 8910335.
- Tatu U, Helenius A «Interactions between newly synthesized glycoproteins, calnexin and a network of resident chaperones in the endoplasmic reticulum.». J. Cell Biol., 136, 3, 1997, pàg. 555–65. DOI: 10.1083/jcb.136.3.555. PMID: 9024687.
- Wiest DL, Bhandoola A, Punt J, et al. «Incomplete endoplasmic reticulum (ER) retention in immature thymocytes as revealed by surface expression of "ER-resident" molecular chaperones.». Proc. Natl. Acad. Sci. U.S.A., 94, 5, 1997, pàg. 1884–9. DOI: 10.1073/pnas.94.5.1884. PMID: 9050874.
- Yu W, Andersson B, Worley KC, et al. «Large-scale concatenation cDNA sequencing.». Genome Res., 7, 4, 1997, pàg. 353–8. PMID: 9110174.