Calci
El calci és l'element químic de símbol Ca i nombre atòmic 20. Igual que els altres metalls alcalinoterris, és un metall reactiu que forma una capa d'òxid-nitrur de color fosc en ser exposat a l'aire. Les seves propietats físiques i químiques són similars a les dels seus homòlegs més pesants, l'estronci i el bari. Es tracta del cinquè element més abundant a l'escorça terrestre i el tercer metall més abundant, després del ferro i l'alumini. El compost de calci més comú a la Terra és el carbonat de calci, que es pot trobar en la pedra calcària i les restes fòssils d'organismes marins primitius. Entre les altres fonts de calci hi ha el guix, l'anhidrita, la fluorita i l'apatita. El seu nom deriva de calx, el nom llatí de la calç, que s'obtenia escalfant la pedra calcària.
| Calci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
20Ca
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris apagat, platejat Calci sòlid  Línies espectrals del calci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Calci, Ca, 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls alcalinoterris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 2, 4, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 40,078(4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 2, 8, 8, 2 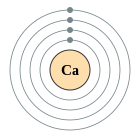
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
1,55 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
1,378 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.115 K, 842 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 1.757 K, 1.484 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 8,54 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 154,7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,929 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | +2, +1[1] (òxid bàsic fort) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 589,8 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.145,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 4.912,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 197 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 176±10 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 231 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 33,6 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 201 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 22,3 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.810 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 20 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 7,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 17 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 1,75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 167 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-70-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del calci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Malgrat que a l'edat antiga ja es coneixien diversos compostos de calci, les seves propietats químiques no es posaren en clar fins al segle xvii. El 1808, Humphry Davy obtingué calci pur mitjançant l'electròlisi del seu òxid i batejà l'element. Els compostos de calci tenen un ús molt ampli en nombroses indústries: com a suplement de calci en el sector alimentari i farmacèutic, com a agent de blanqueig en la indústria paperera, com a component del ciment i els aïlladors elèctrics i en la fabricació de sabó.
És un element essencial per a la vida. Es calcula que entre un 1,5% i un 2% del pes d'una persona és calci, del qual el 99% es troba en els ossos i la resta en teixits i líquids corporals intervenint en el metabolisme cel·lular.
En la parla vulgar s'utilitza la veu calci per a referir-se a les seves sals (v.g., 'aquesta aigua té molt calci; en les canonades es diposita molt calci, etc.)
Història
modificaEl calci va ser descobert el 1808 per Humphry Davy per mitjà d'electròlisi d'una amalgama de mercuri i calç. Davy va mesclar calç humitejada amb òxid de mercuri (HgO) que va col·locar sobre una làmina de platí, l'ànode, i va submergir una part de mercuri en l'interior de la pasta que faria de càtode; per electròlisi va obtenir una amalgama que destil·lada va deixar un residu sòlid molt oxidable, encara que ni tan sols el mateix Davy estava molt segur d'haver obtingut calci pur; amb posterioritat Bunsen el 1854 i Matthiessen el 1856 van obtenir el metall per electròlisi del clorur de calci (CaCl₂), i Henri Moissan va obtenir calci amb una puresa del 99% per electròlisi del iodur de calci (CaI₂). No obstant això, fins a principis del segle xx el calci només s'obtenia en laboratori.
Abundància i obtenció
modificaÉs el cinquè element en abundància en l'escorça terrestre (3,6% en pes) però no es troba en estat nadiu sinó formant compostos amb gran interès industrial com el carbonat (calcita, marbre, calcària i dolomita) i el sulfat (algeps, alabastre) a partir dels quals s'obtenen la calç viva, l'escaiola, el ciment, etc.; altres minerals que el contenen són fluorita (fluorur), apatita (fosfat) i granit (silicat).
El metall s'aïlla per electròlisi del clorur de calci (subproducte del procés Solvay) fos:
Característiques principals
modificaEl calci és un metall alcalinoterri bla, mal·leable i dúctil que crema amb flama roja formant òxid de calci i nitrur. Les superfícies recents són de color blanc platejat, però empal·lideixen ràpidament tornant-se lleugerament groguenques exposades a l'aire i en última instància grisa o blanques per la formació de l'hidròxid de calci al reaccionar amb la humitat ambiental. Reacciona violentament amb l'aigua per a formar l'hidròxid Ca(OH)₂ desprenent hidrogen.
Isòtops
modificaEl calci té sis isòtops estables dels quals el Ca-40 és el més abundant (97%). El Ca-40 i el Ar-40 són productes de la desintegració del K-40, però mentre que el segon s'ha usat per a la datació en geologia, la prevalença de l'isòtop Ca-40 en la naturalesa ha impedit fer el mateix amb el calci.
A diferència d'altres isòtops cosmogènics produïts en l'atmosfera terrestre, el Ca-41 es produeix per activació neutrónica del Ca-40, de manera que se sintetitza en les capes més superficials del sòl, en les que el bombardeig de neutrons és prou intens. A més d'això, el Ca-41 ha rebut l'atenció dels científics perquè es desintegra en K-41, un indicador crític de les anomalies del sistema solar.
Aplicacions
modificaPaper biològic
modificaEl calci actua com a mediador intracel·lular complint una funció de segon missatger. Per exemple, el catió Ca2+ intervé en la contracció dels músculs. També està implicat en la regulació d'alguns enzims cinases que realitzen funcions de fosforilació, per exemple la proteïna-cinasa C (PKC), i realitza unes funcions enzimàtiques semblants a les del magnesi en processos de transferència de fosfat (per exemple, l'enzim fosfolipasa A₂).
Algunes de les seves sals són prou insolubles, per exemple el sulfat (CaSO₄), carbonat (CaCO₃), oxalat, etc., i forma part de distints biominerals. Així, en el ser humà, està present en els ossos en forma d'hidroxiapatita càlcic, Ca10(OH)₂(PO₄)₆, en les dents com fluorohidroxiapatita càlcic (alguns OH- se substituïxen per F-), o com a carbonat de calci en l'orella interna. Altres biominerals es troben presents en exoesquelets, en petxines o en la closca d'ou de distints animals i en forma de distintes sals.
Una altra funció del calci està relacionada amb la coagulació de la sang, a través de la seva relació amb la proteïna protrombina.
És, per tant, un important component de la dieta. La quantitat diària recomanada per als adults oscil·la entre 800-1000 mg, quantitat que ha d'incrementar-se durant el creixement (9-18 anys) i l'embaràs i la lactància, i després de la menopausa, fins als 1200-1300 mg; els productes comercials especifiquen en el seu etiquetatge la quantitat de calci que proporcionen, expressada en tant per cent respecte a la c. d. r., perquè el consumidor sàpia si està ingerint la quantitat diària recomanada (en les situacions especials descrites hauria de consumir-se entorn d'un 130%). Productes rics en calci són la llet i els derivats lactis (el calci dels quals és fàcilment absorbit), els vegetals (fesols, espinacs), els peixos que es mengen amb espina (sardina, anxova), etc. i els aliments enriquits amb calci.
La competència que s'establix entre certs minerals pot inhibir l'absorció del calci; així, calci i magnesi competixen pels mateixos punts d'absorció, per la qual cosa aquelles persones que estiguen prenent suplements del segon hauran de tindre especial atenció amb l'aporte diari de calci.
El dèficit de calci és susceptible de provocar osteoporosi i hipocalcèmia, mentre que el seu excés provoca hipercalcèmia.
Referències
modifica- ↑ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias «Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes». Journal of the American Chemical Society, 132, 35, 2010, pàg. 100818110534020. DOI: 10.1021/ja105534w. PMID: 20718434.
Enllaços externs
modifica- Institut Nacional de Salut Infantil i Desenvolupament Humà, EUA (castellà)
- Enciclopèdia Lliure - Calci (castellà)
- webelements.com – Calci (anglès)
- environmentalchemistry.com – Calci (anglès)