Bor
El bor és un element químic de la taula periòdica que té el símbol B i nombre atòmic 5. És un element metal·loide, semiconductor, trivalent que existeix abundantment en el mineral bòrax. Hi ha dos al·lòtrops del bor; el bor amorf és una pols marró, però el bor metàl·lic és negre. La forma metàl·lica és dura (9,3 en l'escala de Mohs) i és un mal conductor a temperatura ambient. No s'ha trobat lliure en la natura.
| Bor | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
5B
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||
Negre-marró  Línies espectrals del bor | |||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||
| Nom, símbol, nombre | Bor, B, 5 | ||||||||||||||||||||||||
| Categoria d'elements | Metal·loides | ||||||||||||||||||||||||
| Grup, període, bloc | 13, 2, p | ||||||||||||||||||||||||
| Pes atòmic estàndard | 10,811(7) | ||||||||||||||||||||||||
| Configuració electrònica | [He] 2s² 2p¹ 2, 3 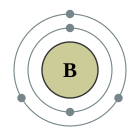
| ||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
2,08 g·cm−3 | ||||||||||||||||||||||||
| Punt de fusió | 2.349 K, 2.076 °C | ||||||||||||||||||||||||
| Punt d'ebullició | 4.200 K, 3.927 °C | ||||||||||||||||||||||||
| Entalpia de fusió | 50,2 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpia de vaporització | 480 kJ·mol−1 | ||||||||||||||||||||||||
| Capacitat calorífica molar | 11,087 J·mol−1·K−1 | ||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||
| Estats d'oxidació | 3, 2, 1[1] (òxid àcid suau) | ||||||||||||||||||||||||
| Electronegativitat | 2,04 (escala de Pauling) | ||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 800,6 kJ·mol−1 | ||||||||||||||||||||||||
| 2a: 2.427,1 kJ·mol−1 | |||||||||||||||||||||||||
| 3a: 3.659,7 kJ·mol−1 | |||||||||||||||||||||||||
| Radi atòmic | 90 pm | ||||||||||||||||||||||||
| Radi covalent | 84±3 pm | ||||||||||||||||||||||||
| Radi de Van der Waals | 192 pm | ||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[2] | ||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) ~10⁶ Ω·m | ||||||||||||||||||||||||
| Conductivitat tèrmica | 27,4 W·m−1·K−1 | ||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) (forma ß) 5–7[3] µm·m−1·K−1 | ||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 16,200 m·s−1 | ||||||||||||||||||||||||
| Duresa de Mohs | ~9,5 | ||||||||||||||||||||||||
| Nombre CAS | 7440-42-8 | ||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||
| Article principal: Isòtops del bor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Història
modificaEls compostos de bor (de l'àrab buraq i aquest del persa burah) es coneixen des de fa milers d'anys. A l'antic Egipte la momificació depenia del natró, un mineral que contenia borats i altres sals comuns. A la Xina s'usaven ja cristalls de borax cap al 300 aC i a l'antiga Roma, compostos de bor en la fabricació de vidre.
El 1808, Humphry Davy, Gay-Lussac i Louis J. Thénard van obtenir bor amb una puresa del 50% aproximadament, encara que cap d'ells va reconèixer la substància com un nou element, cosa que faria Jöns Jacob Berzelius en 1824. El bor pur va ser produït per primera vegada pel químic nord-americà Ezekiel Weintraub, el 1909.
Abundància i obtenció
modificaEls Estats Units d'Amèrica (desert de Mojave, a Califòrnia) i Turquia són els majors productors de bor. L'element es troba combinat amb bòrax, àcid bòric, colemanita, kernita, ulexita i borats. L'àcid bòric es troba a vegades en les aigües volcàniques. La ulexita és un mineral que de manera natural presenta les propietats de la fibra òptica.
El bor pur és difícil de preparar; els primers mètodes usats requerien la reducció de l'òxid amb metalls com el magnesi o alumini, però el producte resultant gairebé sempre es contaminava. Pot obtenir-se per reducció d'halogenurs de bor volàtils amb hidrogen a alta temperatura.
Característiques
modificaEl bor és un element amb vacants electròniques en l'orbital p; per això presenta una acusada apetència d'electrons, de manera que els seus compostos es comporten sovint com a àcids de Lewis, reaccionant amb rapidesa amb substàncies riques en electrons.
Entre les característiques òptiques d'aquest element, s'inclou la transmissió de radiació infraroja. A temperatura ambient, la seva conductivitat elèctrica és xicoteta, però és bon conductor de l'electricitat a alta temperatura.
Aquest metal·loide té la més alta resistència a la tracció entre els elements químics coneguts; el material fos amb arc té una resistència mecànica entre 1600 i 2400 MPa.
El nitrur de bor, un aïllant elèctric que condueix la calor tan bé com els metalls, s'empra en l'obtenció de materials tan durs com el diamant. El bor té a més qualitats lubricants semblants a les del grafit, i comparteix amb el carboni la capacitat de formar xarxes moleculars mitjançant enllaços covalents estables.
Isòtops
modificaEn la naturalesa es troben dos isòtops de bor: B-11 (80,1%) i B-10 (19,9%).
Aplicacions
modificaEl compost de bor de major importància econòmica és el bòrax, que s'empra en grans quantitats en la fabricació de fibra de vidre aïllant i perborat de sodi. Altres usos inclouen:
- Les fibres de bor usades en aplicacions mecàniques especials, en l'àmbit aeroespacial, aconsegueixen resistències mecàniques de fins a 3600 MPa.
- El bor amorf s'usa en focs artificials pel seu color verd.
- L'àcid bòric s'empra en productes tèxtils.
- Els compostos de bor tenen moltes aplicacions en la síntesi orgànica i en la fabricació de vidres de borosilicat.
- Alguns compostos s'empren com a conservants de la fusta, sent de gran interès el seu ús per la seva baixa toxicitat.
- El B-10 s'usa en el control dels reactors nuclears, com a escut enfront de les radiacions i en la detecció de neutrons.
Segons l'estudi del seu ús com a combustible de coets, els hidrurs de bor s'oxiden amb facilitat, alliberant gran quantitat d'energia.
Precaucions
modificaNi el bor ni els borats són tòxics; no obstant això, alguns dels més exòtics compostos de bor i hidrogen són tòxics i han de manipular-se amb atenció.
Referències
modifica- ↑ Zhang, K.Q.; Guo, B.; Braun, V.; Dulick, M.; Bernath, P.F. «Infrared Emission Spectroscopy of BF and AIF». J. Molecular Spectroscopy, 170, 1995, pàg. 82. Arxivat de l'original el 2012-01-11. Bibcode: 1995JMoSp.170...82Z. DOI: 10.1006/jmsp.1995.1058 [Consulta: 14 abril 2013]. Arxivat 2012-01-11 a Wayback Machine.
- ↑ Lide, David R. (ed.). Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press, 2000. ISBN 0849304814 [Consulta: 14 abril 2013].
- ↑ Holcombe Jr., C. E.; Smith, D. D.; Lorc, J. D.; Duerlesen, W. K.; Carpenter; D. A. «Physical-Chemical Properties of beta-Rhombohedral Boron». High Temp. Sci., 5, 5, 10-1973, pàg. 349–57.
- ↑ 4,0 4,1 «Atomic Weights and Isotopic Compositions for All Elements». National Institute of Standards and Technology.
- ↑ Szegedi, S.; Váradi, M.; Buczkó, Cs. M. [et al]. «Determination of boron in glass by neutron transmission method». Journal of Radioanalytical and Nuclear Chemistry Letters, 146, 3, 1990, pàg. 177. DOI: 10.1007/BF02165219.