Isòtop
Els isòtops d'un element químic són àtoms amb el mateix nombre atòmic (nombre de protons), però diferent nombre màssic (protons més neutrons). És a dir, els seus nuclis atòmics tenen el mateix nombre de protons però diferent nombre de neutrons .[1]
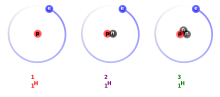
El nom, basat en els mots grecs ἰσο-, iso-, mateix, i τόπος, topos, lloc, fou adoptat pel radioquímic anglès Frederick Soddy, a partir d'un suggeriment de la metgessa i escriptora Margaret Todd,[2] a causa del fet que els isòtops ocupen el mateix lloc en la taula periòdica dels elements.[3]
En el llenguatge comú és habitual utilitzar la paraula isòtop per a referir-se a cada espècie caracteritzada per un determinat conjunt del valor i . Estrictament, tal espècie hauria de ser denominada núclid, i reservar-se la paraula isòtop per als núclids que pertanyen a un mateix element. Així, els núclids carboni 12 i carboni 14 són isòtops de l'element carboni.
Història modifica
L'existència dels isòtops fou descoberta a conseqüència de l'estudi de les substàncies radioactives naturals. Frederick Soddy (1877-1956) treballà amb el físic britànic Ernest Rutherford (1871-1937) estudiant la desintegració dels elements radioactius i el 1913 fou un dels primers a arribar a la conclusió del fet que existien alguns elements químics que tenien un nombre màssic diferent, però que no es podien diferenciar ni separar químicament.[2] El 1921 fou guardonat amb el Premi Nobel de Química per la seva contribució al coneixement de la química de les substàncies radioactives i les seves investigacions sobre l'origen i la natura dels isòtops.[4]
A principis del segle XX començaren a descobrir-se alguns productes intermedis de les cadenes de desintegració dels elements radioactius. Segons Frederick Soddy mateix, la història dels isòtops començà amb el descobriment del radio-tori pel químic escocès William Ramsay (1852-1916) i l'alemany Otto Hahn (1879-1968) el 1905, llavors un nou producte de la desintegració del tori que avui coneixem com a tori 228. El mateix any, el químic polonès Tadeusz Godlewski (1878-1921) descobrí l'actini X (223Ra). El 1907 Otto Hahn descobrí el meso-tori un producte intermedi entre el tori i el radio-tori i el 1908 trobà que en realitat n'eren dos productes. Es feren molts intents d'aïllar el radio-tori, però tots els esforços foren debades. Finalment, s'arribà a la conclusió del fet que no era possible separar-lo per mitjans químics i es trobà que el meso-tori esdevenia radio-tori espontàniament (com a producte del procés de la seva desintegració radioactiva.[5]
Característiques modifica
Tots els elements químics tenen un o més isòtops.[6] La majoria dels elements naturals són formats per diversos isòtops, les seves proporcions no canvien mai a conseqüència de reaccions químiques, són només el resultat de reaccions nuclears.[7] Les propietats químiques dels isòtops d'un mateix àtom són les mateixes, són determinades pel nombre d'electrons, no pas per la massa del nucli.[8]
En canvi, les propietats físiques dels nuclis atòmics poden ser molt diferents. Per exemple, el temps de vida mitjana dels isòtops 12 i 14 del carboni és molt diferent, cosa que es pot aprofitar per datar mostres d'interès històric o arqueològic d'origen orgànic. Els isòtops només poden ser separats per procediments físics (difusió, centrifugació, espectrometria de masses, destil·lació fraccionada i electròlisi). Hom classifica els isòtops en estables, amb una vida mitjana de l'ordre de 3 000 milions d'anys, i inestables o radioactius, que emeten radiacions i es converteixen en altres isòtops o elements.[1]
Si la relació entre el nombre de protons i de neutrons no és l'apropiat per a obtenir l'estabilitat nuclear, l'isòtop és inestable, i per tant radioactiu.
| Isòtop | Nuclis per milió |
|---|---|
| Hidrogen1 | 705.700 |
| Hidrogen 2 | 23 |
| Heli 4 | 275.200 |
| Heli 3 | 35 |
| Oxigen 16 | 5.920 |
| Carboni 12 | 3.032 |
| Carboni 13 | 37 |
| Neó 20 | 1.548 |
| Neó 22 | 208 |
| Ferro 56 | 1.169 |
| Ferro 54 | 72 |
| Ferro 57 | 28 |
| Nitrogen 14 | 1.105 |
| Silici 28 | 653 |
| Silici 29 | 34 |
| Silici 30 | 23 |
| Magnesi 24 | 513 |
| Magnesi 26 | 79 |
| Magnesi 25 | 69 |
| Sofre 32 | 396 |
| Argó 36 | 77 |
| Calci 40 | 60 |
| Alumini 27 | 58 |
| Níquel 58 | 49 |
| Sodi 23 | 33 |
Nomenclatura modifica
Els isòtops poden anomenar-se de tres maneres diferents indicant sempre el nom de l'element o el seu símbol químic i el seu nombre màssic:
- Amb el nom de l'element, un espai, i a continuació el nombre màssic, com ara calci 48 o urani 235.[10]
- Amb el símbol de l'element, un guió i el nombre màssic. És el cas de Ca-48 o U-235.[10]
- Amb el símbol de l'element i el nombre màssic situat com a superíndex a l'esquerra del símbol. Pels isòtops anteriors seria 48Ca i 235U.[10]
Separació d'isòtops modifica
Separació electromagnètica modifica
El mètode electromagnètic de separació d'isòtops de l'urani fou estudiat inicialment pel físic estatunidenc Alfred Nier (1911-1994) de la Universitat de Minnesota. Nier emprà un espectròmetre de masses per enviar un corrent de partícules carregades accelerades dins d'un camp elèctric a través d'un fort camp magnètic. Els àtoms de l'isòtop més lleuger (U-235) es desviarien més pel camp magnètic que els de l'isòtop més pesat (U-238), resultant en dos corrents que podrien ser recollits per receptors diferents.[11]
Ernest O. Lawrence (1901-1958) del Laboratori de Radiació de la Universitat de Califòrnia a Berkeley convertí el seu gegantí ciclotró per aconseguir aquesta forma de separació de manera més eficient. Aquest model conduí al posterior disseny i construcció de l'enorme complex a Oak Ridge, Tennessee. Degut al seu cost exorbitant, la separació electromagnètica fou gairebé abandonada després de la guerra per a la producció d'armes, però jugà un paper important en el desenvolupament del camp de la medicina nuclear.[11]
Centrifugació modifica
Una centrifugadora fou el primer dispositiu utilitzat per separar isòtops. El clor 35 fou separat del clor 37 el 1934 pel físic estatunidenc Jesse Beams (1898-1977) de la Universitat de Virgínia. Els físics nord-americans consideraren que la centrifugadora era la millor opció per a l'enriquiment de l'urani per a fins militars a gran escala l'any 1940, i Beams rebé finançament del govern per intentar l'enriquiment d'urani mitjançant centrifugació.[11]
La força centrífuga en un cilindre que gira ràpidament sobre el seu eix vertical podria separar una mescla gasosa de dos isòtops. Això és a causa que l'isotop més lleuger, l'U-235, seria menys afectat per l'acció i podria ser extret a la part superior central del cilindre. Un sistema en cascada format per milers de centrifugadores podria produir una mescla enriquida.[11] Tanmateix la centrifugadora de Beams requeria una enorme quantitat d'energia i només podia funcionar durant un curt període temps per la qual cosa no era adequada per a la producció industrial. Els científics del Projecte Manhattan optaren el 1944 per la difusió gasosa en lloc de les centrifugadores de gas com a mètode principal per a la separació dels isotops d'urani.[11]
No obstant això, a principis de la dècada de 1950, un presoner de guerra alemany a la Unió Soviètica construí una centrifugadora eficient i duradora. Mentre les centrifugadores es consideraven una causa perduda en l'enginyeria nuclear nord-americana, els científics estrangers continuaven treballant en aquest àmbit. Els físics soviètics van pensar, amb encert, que la difusió gasosa no tenia sentit, ja que consumiria més energia del que podria produir. Max Steenbeck (1904-1981) i Gernot Zippe (1917-2008), presoners de guerra d'Alemanya i Àustria treballant en un camp de presoners de guerra realitzaren diverses millores en el disseny de Beams. El rotor de la centrifugadora es fe girar sobre la punta d'una agulla, com una baldufa, eliminant així la fricció, mentre que la centrifugadora es feia girar mitjançant un camp electromagnètic. Després de ser alliberat del camp de presoners, Steeneck tornà a Alemanya de l'Est, mentre que Zippe comercialitzà la seva centrifugadora per tot el món. A finals de la dècada de 1950, Zippe treballà com a investigador a la Universitat de Virgínia, on els oficials de la Comissió d'Energia Atòmica es maravellaren de la simplicitat del seu disseny i la tasca per construir una centrifugadora progressà amb molta facilitat. Aquest disseny s'estengué per esdevenir el mètode principal d'enriquiment d'urani i continua sent-ho avui en dia.[11]
Producció modifica
Hi ha isòtops que es troben a la naturalesa perquè són estables i altres són inestables però es van produint per les cadenes de desintegració dels isòtops de l'urani, del tori o del neptuni. Malgrat aquests són inestables, el seus període de semidesintegració són molt grans i es van desintegrant molt lentament en isòtops inestables que, en desintegrar-se, en generen altres fins a arribar als isòtops del plom que són estables. Per altra banda, mitjançant reaccions nuclears es poden sintetitzar isòtops inestables que no existeixen a la naturalesa. Aquests, en desintegrar-se donen lloc a altres isòtops fins que s'arriba a un que sigui estable.
Producció mitjançant reactors modifica
Els isòtops poden ser produïts en reactors nuclears exposant materials diana adequats al flux intens de neutrons del reactor durant un temps apropiat. En reactors del tipus de piscina moderats amb aigua lleugera, el nucli compacte és accessible des de la part superior de la piscina. Els materials diana a irradiar són tancats en càpsules, carregats en muntatges senzills i baixats a posicions predeterminades del nucli per a la irradiació. Posteriorment, les dianes irradiades són carregades en recipients adequats de protecció i transportades als laboratoris de química calenta per al seu processament. En reactors moderats amb aigua pesant, del tipus de tanc, alimentats amb urani, s'utilitzen muntatges sofisticats que contenen nombroses càpsules diana per a les irradiacions. En ambdós enfocaments, la qualitat i l'activitat específica dels isòtops produïts depenen tant del material diana com de les condicions de irradiació.[12]
Una àmplia gamma d'isòtops es produeixen en reactors, des d'elements tan lleugers com el carboni 14 fins a tan pesants com el mercuri 203, amb irradiacions que varien des de minuts fins a setmanes. Per exemple, el molibdè 99, progenitor del radioisòtop de diagnòstic mèdic àmpliament utilitzat Tc-99m, generalment es produeix mitjançant fissió nuclear induïda per neutrons de dianes amb urani 235, amb un temps d'irradiació de 4 a 8 dies.[12] També es produeix per irradiació amb neutrons d'una diana de Mo-98, segons la reacció:[13]
Producció mitjançant acceleradors modifica
Els acceleradors de partícules són utilitzats per bombardejar dianes de producció amb feixos de nuclis carregats que impacten en les dianes per produir una àmplia gamma d'isòtops, incloent molts nuclis rics en protons (F-18, C-11) que no estan disponibles en reactors.[12] La reacció del fluor 18, molt emprat en medicina, empra aigua enriquida amb oxigen 18 que es bombardejada amb protons:[14]
Els acceleradors principalment s'utilitzen feixos de protons i deuterons, però en principi també són possibles partícules α i feixos d'ions més pesants. Alternativament, es poden bombardejar dianes primàries per a produir neutrons o fotons, que després impacten en la diana de producció per a formar els isotops d'interès. El rang d'energies i intensitats de partícules varia entre les instal·lacions (per exemple, de 10 a 100 MeV per a ciclotrons comercials dedicats a la producció d'isòtops, o fins a 200 MeV en alguns acceleradors de recerca). Per exemple, el Brookhaven Linac Isotope Producer (BLIP) al Brookhaven National Laboratory utilitza un feix de protons de 200 MeV i 140 µA procedent del Alternating Gradient Synchrotron per a bombardejar mostres i produir Ge-68/Ga-68, Sr-82/Rb-82, així com Zn-65, Mg-28, Fe-52 i Rb-83. Un altre exemple és la Isotope Production Facility (IPF) al Los Alamos National Laboratory, que utilitza un feix de protons de 100 MeV i 250 µA procedent del LANSCE linac per a produir Ge-68/Ga-68 i Sr-82/Rb-82, així com quantitats menors d'Al-26 i Si-32.[12]
Per exemple el Mo-99 es produeix en acceleradors mitjançant les següents reaccions, entre altres:[13]
Isòtops d'elements químicsmolt pesants i altament inestables se sintetitzen en acceleradors emprant cations d'elements lleugers que impacten contra nuclis d'elements pesants. Per exemple la síntesi del nihoni 278 es realitzà bombardejaren un núclid de bismut 209 amb cations zinc 70:[15]
Aplicacions dels isòtops modifica
Existeixen nombroses aplicacions que utilitzen les diferències de propietats entre diferents isòtops del mateix element.
Marcatge isotòpic modifica
Amb el marcatge isotòpic, s'usen isòtops inusuals com a marcadors de reaccions químiques per conèixer el mecanisme que segueixen. Els isòtops afegits reaccionen químicament igual que els presents, però després es poden identificar per espectrometria de masses o espectroscòpia infraroja. Si es fan servir radioisòtops, es poden detectar també gràcies a les radiacions que emeten i la tècnica s'anomena marcatge radioactiu o marcatge radioisotòpic. Són molt emprats en bioquímica i química orgànica els isòtops estables deuteri, carboni 13, nitrogen 15 i oxigen 18.[16]
Datació radioactiva modifica
La datació radioactiva és una tècnica similar, però en la qual es compara la proporció de certs isòtops d'una mostra, amb la proporció que es troba en la natura. Potser la més important és la datació per radiocarboni, basada en el càlcul de la quantitat de carboni 14 que conté la resta arqueològica d'un ésser viu i en el fet que aquest isòtop, després de la mort, es redueix a la meitat cada 5 730 anys. En geologia es fa servir la datació per potassi-argó, tècnica de datació absoluta de materials geològics formats per solidificació basada en el procés de transformació radioactiva del potassi 40 en argó 40. També és molt utilitzada en arqueologia la datació per urani-tori, tècnica de datació radioactiva basada en la ruptura de l'equilibri secular de la sèrie radioactiva de l'urani 238 i en el procés de desintegració radioactiva d'aquest en tori 230.[17]
Substitució isotòpica modifica
La substitució isotòpica, es pot usar per a determinar el mecanisme d'una reacció gràcies a l'efecte cinètic isotòpic. Aquest efecte és la disminució de la velocitat de reacció que es produeix quan en una reacció se substitueix un àtom d'un reactiu per un isòtop seu més pesant. Es distingeix entre l'efecte isotòpic cinètic primari, que s'observa quan l'etapa determinant de la velocitat comporta el trencament d'un enllaç en el qual està implicat l'isòtop pesant, i l'efecte isotòpic cinètic secundari, que s'observa encara que en el transcurs de la reacció no es trenqui cap enllaç que impliqui l'isòtop pesant. Ambdós tipus es deuen als canvis que provoca la substitució isotòpica en l'energia vibracional de punt zero del sistema reactant.[18]
Anàlisi isotòpica modifica
L'anàlisi isotòpica és la tècnica de determinació de l’abundància relativa dels diversos isòtops d’un cert element en un producte donat. L’anàlisi isotòpica utilitza, bé les propietats que depenen només de la diferència de massa entre els isòtops (mesura de densitats, mesura de conductivitat tèrmica de gasos, espectrometria de massa, mesura de les freqüències espectrals característiques en els espectres atòmics i moleculars), bé les propietats intrínsecament nuclears (ressonància magnètica nuclear i, en el cas dels isòtops radioactius, detecció i mesura de la radiació emesa).
Per exemple restes de teixits recuperats en jaciments arqueològics, com ara ossos, dents, residus orgànics, cabells o closques marines, poden ser analitzats isotòpicament. La distribució dels isòtops del carboni i del nitrogen s'usen per reconstruir la dieta, i els isòtops de l'oxigen solen determinar l'origen geogràfic i el paleoambient. Els isòtops d'estronci i de plom es poden utilitzar per analitzar els moviments de les poblacions, hàbits migratoris i mobilitat estacional.[20] En arqueologia és comú combinar elements en l'anàlisi isotòpic per reconstruir la dieta, el canvi en les fonts d'aigua, les migracions i les interaccions culturals.[21]
Els isòtops de carboni entren en la cadena alimentària quan els herbívors consumeixen plantes, i els isòtops d'oxigen s'introdueixen en la cadena alimentària en consumir aigua lliure i l'aigua continguda en la dieta. Examinant la proporció dels isòtops 12C/13C, és possible determinar si els animals van menjar predominantment plantes dels tipus C3 o C4. Fonts alimentàries potencials del tipus C3 inclouen l'arròs, els tubercles, les fruites, els fruits secs i moltes verdures, mentre que les fonts alimentàries del tipus C4 inclouen el mill i la canya de sucre.[21] Els isòtops de carboni també es poden utilitzar per distingir entre fonts d'aliments marins, d'aigua dolça i terrestres.
Ressonància magnètica nuclear modifica
Diferents varietats de l'espectroscòpia, es basen en les propietats úniques de núclids específics. Per exemple, l'espectroscòpia per ressonància magnètica nuclear (RMN), permet estudiar només isòtops amb un spin diferent de zero, i els núclids més usats són ¹H, ²H, 13C, i 31P.[22]
Espectroscòpia Mössbauer modifica
L'espectroscòpia Mössbauer, també es basa en les transicions nuclears de núclids específics, com el 57Fe.[23]
Energia nuclear modifica
Els radionúclids, també tenen aplicacions importants, les centrals nuclears i les armes nuclears requereixen quantitats elevades de certs núclids. Els processos de separació isotòpica o enriquiment isotòpic, representen un desafiament tecnològic important ja que pocs isòtops són fissibles. Per exemple a la natura l'isòtop més abundant (99,27 %) de l'urani és l'urani 238 que no és fissible, però sí ho és l'urani 235, que és poc abundant (0,72 %). La reacció de fissió general de l'urani 235 i un exemple són:[24]
Vegeu també modifica
Referències modifica
- ↑ 1,0 1,1 Gran Enciclopèdia Catalana. Volum 13. Reimpressió d'octubre de 1992. Barcelona: Gran Enciclopèdia Catalana, 1992, p. 169. ISBN 84-7739-008-8.
- ↑ 2,0 2,1 «Frederick Soddy» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, Inc.. [Consulta: 29 agost 2021].
- ↑ Soddy, Frederick «The origins of the conceptions of isotopes» (PDF) (en anglès). Nobel Lectures, Desembre 1922, pàg. 393 [Consulta: 29 agost 2021]. «Thus the chemically identical elements - or isotopes, as I called them for the first time in this letter to Nature, because they occupy the same place in the Periodic Table - are elements with the same algebraic or nettnuclear charge, but with different numbers of + and - charges in the nucleus.»
- ↑ «The Nobel Prize in Chemistry 1921» (en anglès). The Nobel Prize. The official website of the Nobel Prize. [Consulta: 29 agost 2021].
- ↑ Soddy, 1922, p. 374-379.
- ↑ «Isotope» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, Inc.. [Consulta: 29 agost 2021].
- ↑ Feynman, 2010, p. 3-12.
- ↑ Feynman, 2010, p. 3-7.
- ↑ Arnett, David. Supernovae and Nucleosynthesis. 1a ed.. Princeton, New Jersey: Princeton University press, 1996. ISBN 0-691-01147-8.
- ↑ 10,0 10,1 10,2 «3.2.1. La simbologia i la formulació en els textos científics – Critèria: espai web de correcció de l'IEC». [Consulta: 17 juny 2019].
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 «Isotope Separation Methods - Nuclear Museum» (en anglès americà). [Consulta: 23 juny 2023].
- ↑ 12,0 12,1 12,2 12,3 «Production Methods | NIDC: National Isotope Development Center». [Consulta: 25 juny 2023].
- ↑ 13,0 13,1 Molybdenum-99 for Medical Imaging. Washington, D.C.: National Academies Press, 2016-10-28. DOI 10.17226/23563. ISBN 978-0-309-44531-3.
- ↑ Cianfarani, Cesidio; Cisbani, Evaristo; Orlandi, Gianluca; Frullani, Salvatore; Picardi, Luigi «F-18 production with the TOP linac injector» (en anglès). Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment, 562, 2, 23-06-2006, pàg. 1060–1063. DOI: 10.1016/j.nima.2006.02.095. ISSN: 0168-9002.
- ↑ Morita, Kosuke; Morimoto, Kouji; Kaji, Daiya; Akiyama, Takahiro; Goto, Sin-ichi «Experiment on the Synthesis of Element 113 in the Reaction 209 Bi(70 Zn,n) 278 113» (en anglès). Journal of the Physical Society of Japan, 73, 10, 15-10-2004, pàg. 2593–2596. DOI: 10.1143/JPSJ.73.2593. ISSN: 0031-9015.
- ↑ Davies, Peter S. W. «Stable isotopes: their use and safety in human nutrition studies» (en anglès). European Journal of Clinical Nutrition, 74, 3, 2020-03, pàg. 362–365. DOI: 10.1038/s41430-020-0580-0. ISSN: 0954-3007. PMC: PMC7561496. PMID: 32047289.
- ↑ «Diccionari d'arqueologia | TERMCAT». [Consulta: 22 juny 2023].
- ↑ «Diccionari de química | TERMCAT». [Consulta: 23 juny 2023].
- ↑ Estarellas, Bartomeu Llull; Mateo, Laura Perelló; Ayuso (†), Víctor M. Guerrero; Pericot, Josep M. Fullola; Mendizàbal, M. Àngels Petit i «Caracterización isotópica y elemental de los metales de Cova des Pas (Ferreries, Menorca). Una necrópolis de transición del Bronce Final al Hierro» (en castellà). Trabajos de Prehistoria, 76, 1, 30-06-2019, pàg. 102–119. DOI: 10.3989/tp.2019.12228. ISSN: 1988-3218.
- ↑ Carlson, A. K. 1996.
- ↑ 21,0 21,1 Cox, K. J., Bentley, R. A., Tayles, N., Buckley, H. R., Macpherson, C. G., & Cooper, M. J. (2011).
- ↑ The Editors of Encyclopaedia Britannica. «nuclear magnetic resonance» (en anglès). Encyclopædia Britannica, 2003.
- ↑ Hogarth, C A «Mössbauer Effect: Principles and Applications». Physics Bulletin, 16, 6, 1965-06, pàg. 243–243. DOI: 10.1088/0031-9112/16/6/008. ISSN: 0031-9112.
- ↑ «Nuclear fission | Examples & Process | Britannica» (en anglès), 23-06-2023. [Consulta: 26 juny 2023].
Bibliografia modifica
- Feynman, Richard P.; Leighton, Robert B.; Matthew, Sands. The Feynman Lectures on Physics (en anglès). Volum I: Mainly Machanics, Radiation, and Heat. Edició New Millennium. Basic Books, Perseus Books Group, 2010. ISBN 978-0-465-02414-8.
Enllaços externs modifica
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Isòtop |
- Taula periòdica amb informació detallada dels isòtops Arxivat 2004-08-30 a Wayback Machine. (anglès)


