Tuli
El tuli és un element químic de la taula periòdica el símbol del qual és Tm i el seu nombre atòmic és 69. Pertany al 6è període de la taula periòdica, a la sèrie dels lantanoides i, amb ells, al conjunt de les terres rares. Fou descobert el 1879 pel químic i geòleg suec Per Theodor Cleve. El nom prové de Thule, illa mítica del nord de l'oceà Atlàntic, descoberta pel navegador grec Píteas, que hi arribà després d'un viatge de sis dies encetat a les illes Òrcades i que era la terra més al nord coneguda en l'edat mitjana.
| Tuli | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
69Tm
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||
Gris platejat Tuli dendrític sublimat i un cub d'1 cm³  Línies espectrals del tuli | |||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Tuli, Tm, 69 | ||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Lantànids | ||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 6, f | ||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 168,93421 | ||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f13 6s2 2, 8, 18, 31, 8, 2 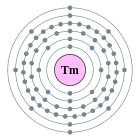
| ||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
9,32 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
8,56 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.818 K, 1.545 °C | ||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 2.223 K, 1.950 °C | ||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 16,84 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 247 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 27,03 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 2, 3, 4 (òxid bàsic) | ||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,25 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 596,7 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 2a: 1.160 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 3a: 2.285 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| Radi atòmic | 176 pm | ||||||||||||||||||||||||||||||||||||
| Radi covalent | 190±10 pm | ||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| ||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic at 300 K | ||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (t, a,) (poli) 676 nΩ·m | ||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 16,9 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (t, a,) (poli) 13,3 µm/(m·K) | ||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 74,0 GPa | ||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 30,5 GPa | ||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 44,5 GPa | ||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,213 | ||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 520 MPa | ||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 471 MPa | ||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-30-4 | ||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del tuli | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Història
modificaEl tuli fou aïllat per primera vegada el 1879 com a l'òxid Tm2O3 pel químic i geòleg suec Per Teodor Cleve (1840-1905) a la Universitat d'Uppsala, Suècia. Els descobriments dels lantanoides començaren amb l'itri el 1794. Estava contaminat amb altres lantanoides que són molt similars químicament. De fet, els primers químics desconeixien que hi eren. El 1843, l'erbi i el terbi foren separats de l'itri, i després, el 1874, Cleve analitzà més detingudament l'òxid d'erbi i s'adonà que havia de contenir altres elements, ja que observà que la seva massa molecular variava lleugerament depenent de la font d'on provenia. La separació cada cop més fina del contingut d'aquest òxid acabaria produint els òxids de dos elements més: holmi i finalment tuli.[1]
El 1911, el químic estatunidenc Charles James (1880-1928)[2] realitzà prop de 15 000 recristal·litzacions de bromat de tuli amb l'objectiu d'obtenir una mostra absolutament pura de l'element[3] i així determinar exactament la seva massa atòmica.
Quan Per Teodor Cleve anomenà tuli l'element descobert el 1879, es degué a un lleu malentès del significat de Thule. Cleve proposà el nom de tuli derivat de Thule, segons ell l'antic nom d'Escandinàvia. Però això és un error que s'ha mantingut en moltes fonts d'informació fins a l'actualitat. A l'època medieval el lloc més llunyà que es podia concebre, més enllà de les fronteres del món conegut, s'anomenava Ultima Thule. Originalment, Thule era el nom clàssic d'una terra misteriosa, sis dies de navegació al nord de la Gran Bretanya, pensada per l'historiador grec Polibi com la part més al nord del món. En les Geòrgiques, Virgili es refereix a Ultima Thule, com un dels extrems de l'oceà fins on s’estén el domini del Cèsar.[1]
Com a símbol químic del tuli, hom vacil·là entre Tu i Tm. El símbol T quedà descartat, encara que era (i és encara) lliure. El símbol Th ja l’ocupava el tori, mentre que el símbol Tl corresponia al tal·li. Després de preponderar el Tu durant unes dècades, finalment s’adoptà oficialment el símbol Tm, per evitar confusions amb el tungstè.[4]
Estat natural i obtenció
modificaL’abundància atòmica del tuli en l’univers és condicionada pels processos de nucleosíntesi de supernoves, per les rutes de desintegració d’elements més pesants i per l’estabilitat dels seus propis isòtops. En aquest sentit, com és el cas d’elements amb nombre atòmic senar, el tuli és un element mononuclídic, amb tan sols 169Tm com a isòtop quasi estable. Això condiciona negativament l’abundor. Dels elements més lleugers, tan sols el tecneci i el prometi són menys abundants que el tuli. I dels elements més pesants, són una bona colla els que el superen en abundància atòmica: iterbi, hafni, tungstè, reni, osmi, iridi, platí, or, mercuri, tal·li, plom, bismut i tori. En el sistema solar, l’abundància atòmica del tuli és de 200 ppb (1 ppb en termes atòmics).[4]
En el planeta Terra, l’abundància global del tuli s’estima en 0,05 ppm en termes de massa (0,007 ppm en termes atòmics). Com s’esdevé amb els elements litòfils, aquesta concentració és superada en l’escorça terrestre, on arriba a 0,48 ppm en termes de massa (0,05 ppm en termes atòmics). No se’l troba mai de manera elemental, sinó combinat (òxids, sals, etc.). Sovint s’associa, com a component minoritari, de minerals que contenen itri i gadolini, com ara la gadolinita, la monazita (70 ppm), la xenotima o l’euxenita. En sòls, la concentració de tuli varia de 0,4-0,8 ppm, amb un valor típic de 0,5 ppm. En resum, és el lantanoide menys abundant en mostres terrestres (exceptuant-hi el prometi, gairebé inexistent).[4]
En la hidrosfera, la concentració de tuli varia segons el context geològic. L’abundància en termes de massa en l’oceà és de 0,25 ppb. En l’atmosfera, la presència de tuli és negligible.[4]
El tuli se'l troba en nombrosos minerals en proporcions molt baixes. Els que en tenen una proporció major que el 0,30 % són: samarskita-(Yb) i iwashiroïta-(Y) 0,54 %, prosxenkoïta-(Y) i hingganita-(Y) 0,39 %, gagarinita-(Ce) 0,36 %, maoniupingita-(Ce) 0,35 %, calcibeborosilita-(Y) 0,32 % i calcigadolinita 0,30 %.[5]
Les reserves accessibles totals de tuli s’avaluen en 100 000 tones, distribuïdes per Àsia, Austràlia, Sud-amèrica, Nord-amèrica i Àfrica. Bona part de la producció es fa a la Xina, a través de l’explotació de sorres fluvials riques en monazita. El contingut de tuli en aquests materials és de l’ordre del 0,5 % (expressat sobre el total de lantanoides) i al voltant d'un 0,007 % del total. És el menys abundant dels lantanoides, però després del descobriment de nous jaciments se'l pot considerar tan rar com l'argent, l'or o el cadmi. Es pot separar de la resta mitjançant noves tècniques de bescanvi iònic i d'extracció. S'aïlla per reducció del seu òxid Tm2O3 amb lantani o a partir del fluorur de tuli(III) TmF3 anhidre amb calci.[6]
Propietats
modificaPropietats físiques
modificaEl tuli és un metall de la sèrie dels lantanoides a la taula periòdica, té una densitat de 9,321 g/cm³ a 25 °C, un punt de fusió de 1 545 °C i un punt d'ebullició de 1 950 °C. És mal·leable i dúctil. És prou tou per poder-lo ratllar amb un ganivet.[6]
La seva configuració electrònica és [Xe]4f 135d06s². A temperatura ambient la seva estructura cristal·lina és hexagonal.[7] És ferromagnètic a temperatures inferiors a 32 K, antiferromagnètic entre 32 i 56 K i paramagnètic per damunt de 56 K.[8]
Propietats químiques
modificaEl tuli s'oxida lentament exposat a l'aire i es crema fàcilment per formar òxid de tuli(III), l'únic òxid conegut:
És força electropositiu i generalment és trivalent. Reacciona lentament amb aigua freda i força ràpidament amb aigua calenta per formar hidròxid de tuli(III):
Reacciona amb tots els halògens donant els corresponents halogenurs de tuli(3+) que són acolorits:
Es dissol fàcilment en àcid sulfúric diluït per formar solucions que contenen els ions tuli(3+) verd pàl·lid, que existeixen com a complexos [Tm(OH2)9]3+.[9]
Malgrat que la majoria dels compostos de tuli presenten cations tuli(3+) també s'han sintetitzat compostos de tuli(2+), com els halogenurs: TmCl2, TmBr2 i TmI2.[6]
Isòtops
modificaEl tuli que hom troba a la natura està constituït únicament per l'isòtop estable tuli 169. S'han obtingut, mitjançant reaccions nuclears, trenta-vuit isòtops del tuli entre el 144Tm i 181Tm, i vint-i-sis isòmers nuclears. El mode de desintegració primària dels isòtops de menor nombre màssic (A < 169) és la captura d'electrons donant isòtops de l'erbi.[10]
El mode principal per a radionúclids de major nombre màssic (A > 169) és l'emissió beta, produint isòtops d'iterbi.[10]
Els radioisòtops de més llarga vida són el tuli 171, que té un període de semidesintegració d'1,92 anys, i el tuli 170, que té un període de semidesintegració de 128,6 dies. La majoria dels altres isòtops tenen períodes de semidesintegració d'uns minuts o menys.[10]
Aplicacions
modificaFabricació d'imants
modificaEl tuli es fa servir en la fabricació d'imants de ceràmica (ferrites Fe2O3 sinteritzades) per a equips de microones.[11]
Medicina
modificaEl làser de tuli (YAG Tm 180) que emet entre una longitud d'ona de 1 930 nm i 2 040 nm s'utilitza amb gran eficiència en el tractament de l'engrandiment benigne de la pròstata (HBP), en els processos de vaporització, coagulació i seccionament de la mateixa.[11]
Altres camps
modificaL'isòtop tuli 170, amb una energia de 85 keV, es fa servir com a font de raigs gamma malgrat tenir un cost elevat i poca disponibilitat al mercat. Tenen una vida útil de vora un any, i que no requereixen grans elements de protecció contra radiacions, més que cobertes de plom. Aquestes fonts són emprades en detecció de defectes en components mecànics i electrònics altrament inaccessibles (radiografia industrial, on el 170Tm és un dels isòtops més difosos). També són usades en diagnòstic dentari, i en altres aplicacions mèdiques diagnòstiques i terapèutiques, com ara en radioteràpia interna antitumoral.[4]
El làser (Ho-Cr-Tm)-YAG és d'alta eficiència i té molts usos en meteorologia i en la indústria armamentística, amb emissions a una longitud d'ona de 2 097 nm.[4]
El tuli(3+) és present en els bitllets d'euro, als quals dona fluorescència de color blau amb llum ultraviolada.[11]
Perillositat
modificaEl tuli no és bioelement, pel que se sap, per cap organisme. Les plantes no l’absorbeixen activament, de manera que les concentracions en la flora són de l’ordre de 0,001 ppm (en termes de massa en relació al pes sec). La concentració en el cos humà és negligible, i és més elevada en fetge, ronyons i ossos (amb una distribució que assenyala el mimetisme parcial dels cations Tm3+ pel Ca2+). La ingesta normal anual de tuli en humans és de l’ordre de micrograms. La toxicitat de les sals de tuli depèn del seu grau de solubilitat, car com més solubles siguin més fàcil serà l’absorció. Els òrgans diana de la toxicitat del tuli en mamífers són el fetge i la melsa, amb afectació també en els nivells d’hemoglobina. Els riscs principals de treballar amb pols de tuli elemental es relacionen amb la tendència a la ignició, però també a la irritabilitat per inhalació o ingesta,[4] i pot causar embòlies pulmonars, especialment durant exposicions llargues.[8]
Pot ser un problema mediambiental, si s'acumula en sòls i en medis aquàtics, el que podria portar a incrementar els seus nivells en els éssers vius, especialment en els humans. Les sals solubles de tuli són lleugerament tòxiques, però les sals insolubles no són tòxiques.[8]
Referències
modifica- ↑ 1,0 1,1 «Thulium - Element information, properties and uses | Periodic Table». Arxivat de l'original el 2021-12-04. [Consulta: 12 febrer 2024].
- ↑ «UNH Magazine: The Life and Work of Charles James». University of New Hampshire Alumni Association. Arxivat de l'original el 2024-02-12. [Consulta: 12 febrer 2024].
- ↑ James, C. «THULIUM I. 1» (en anglès). Journal of the American Chemical Society, 33, 8, 1911-08, pàg. 1332–1344. Arxivat de l'original el 2020-03-15. DOI: 10.1021/ja02221a007. ISSN: 0002-7863 [Consulta: 8 gener 2020].
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 López, D. «Els empèdocles moderns – Per Teodor Cleve (1879) i l’element 69 (Tm) – tuli (nilhexenni, Nhe)». Des de la Mediterrània, 21-05-2015. Arxivat de l'original el 2024-07-22. [Consulta: 12 febrer 2024].
- ↑ «Mineral Species sorted by the element Tm Thulium». [Consulta: 8 gener 2020].
- ↑ 6,0 6,1 6,2 William M. Haynes. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. 92a edició. Boca Raton, FL.: CRC Press, 2011. ISBN 978-1-4398-5511-9. Arxivat 2024-06-19 a Wayback Machine.
- ↑ «Thulium | chemical element» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 15-04-2019. Arxivat de l'original el 2020-05-29. [Consulta: 9 gener 2020].
- ↑ 8,0 8,1 8,2 González Pérez, J.M. «Z = 69, tulio, Tm. El menos abundante de los lantánidos encontrados de manera natural». An. Quim., 115, 2, 2019, pàg. 131. Arxivat de l'original el 2020-02-06 [Consulta: 6 febrer 2020].
- ↑ «WebElements Periodic Table » Thulium » reactions of elements». Arxivat de l'original el 2021-11-19. [Consulta: 9 gener 2020].
- ↑ 10,0 10,1 10,2 «Nudat 2» (en anglès). National Nuclear Data Center, Brookhaven National Laboratory. Arxivat de l'original el 2020-11-27. [Consulta: 21 maig 2020].
- ↑ 11,0 11,1 11,2 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. Universitat Politècnica de Catalunya, 2017. ISBN 978-84-9880-666-3. Arxivat 2024-05-16 a Wayback Machine.
Enllaços externs
modifica- Los Alamos National Laboratory's - Tuli Arxivat 2004-04-15 a Wayback Machine. (anglès)
- It's Elemental - Tuli (anglès)
- webelements.com - Tuli (anglès)
- environmentalchemistry.com - Tuli (anglès)