Pal·ladi (element)
El pal·ladi és l'element químic de símbol Pd i nombre atòmic 46. És un metall de transició del grup del platí, bla (en el sentit de poc dur), dúctil, mal·leable i poc abundant. S'assembla químicament al platí i s'extrau d'algunes menes de coure i níquel. Fou descobert el 1802 pel químic anglès William H. Wollaston. S'empra principalment com catalitzador i en joieria.
| Pal·ladi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
46Pd
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Blanc platejat  Línies espectrals del pal·ladi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Pal·ladi, Pd, 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 10, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 106,42 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d10 2, 8, 18, 18 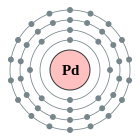
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
12,023 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
10,38 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.828,05 K, 1.554,9 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.236 K, 2.963 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 16,74 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 362 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,98 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 0, +1, +2, +4, +6 (òxid bàsic feble) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,20 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 804,4 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.870 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.177 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 137 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 139±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 163 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 105,4 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 71,8 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 11,8 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.070 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 121 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 180 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 4,75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 461 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 310 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-05-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del pal·ladi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Història modifica
Ja l'any 1700 els miners al Brasil coneixien un metall que anomenaven ouro podre, "or podrit", que és un aliatge natural constituït pel 86 % d'or, 10 % de pal·ladi i 4 % d'argent. Tanmateix, no fou a partir d'aquest aliatge que s'extragué per primera vegada el pal·ladi, sinó del platí. El 1802, el químic anglès William Hyde Wollaston (1776-1828) dissolgué una mostra de platí en aigua règia (àcid nítric + àcid clorhídric) però no aconseguí dissoldre tota la mostra com era habitual i quedà un residu negre. D'aquest residu el seu company Smithson Tennant (1761–1815) aïllà l'osmi i l'iridi. Wollaston estudià la dissolució del platí. Neutralitzà els àcids amb hidròxid de sodi i seguidament hi addicionà clorur d'amoni aconseguint precipitar únicament el platí amb el complex hexacloroplatinat d'amoni . A la dissolució lliure de platí hi anà addicionant gota a gota una dissolució de cianur de mercuri(II) obtenint un precipitat groc de cianur de pal·ladi. Separà aquest precipitat i l'escalfà aconseguint pal·ladi metall. Decidí anomenar-lo pal·ladi en honor del segons asteroide descobert, Pal·les, que s'havia observat per primera vegada el març del 1802.[2]
Però Wollaston no anuncià el seu descobriment i el posà a la venda com a «nou argent» a un preu sis vegades superior al de l'or. L'editor del Journal of Natural Philosophy, Chemistry and the Arts, William Nicholson (1753-1815), publicà els detalls del nou descobriment sense mencionar el seu descobridor. El químic irlandès Richard Chenevix (1774–1803), intrigat, en comprà alguns trossos, i en estudiar-los conclogué que era un aliatge de mercuri i platí, comunicant el suposat frau a la Royal Society. Wollaston, mitjançant Nicholson, oferí un premi de 20 ₤ (unes 2 000 ₤ actuals) a la persona que aconseguís el «nou argent» a partir d'altres metalls. Ningú es presentà i el febrer de 1805, Wollaston es revelà com el seu descobridor i el juny del mateix any donà una explicació completa i convincent sobre el metall i les seves propietats en una reunió de la Royal Society.[2]
Estat natural i obtenció modifica
El pal·ladi és un element poc abundant a l'escorça terrestre, ocupa la posició 76a pel que fa a abundància dels elements químics.[2] S'han descrit setanta-dos minerals que contenen pal·ladi, molts d'ells en proporcions altes. Els que en tenen més del 75 % són: mertieïta-I , 79,36 %; pal·ladi natiu , 79,24 %; stillwaterita , 79,11 %; arsenopal·ladinita , 77,43 %; i vasilita , 77,11 %.[3]
És un metall estratègic de disponibilitat limitada, el preu superà al de l'or el 2018. L'augment de la demanda de vehicles de gasolina a causa de les restriccions dels motors dièsel ha disparat la seva demanda. El seu proveïment està sotmès a tensions geopolítiques, amb un control gairebé monopolístic de l'oferta per part de Rússia i amb un risc en augment pel seu ús creixent. El 2019 la producció mundial de pal·ladi fou de 210 tones, essent els principals productors Rússia (86 tones), Sud-àfrica (80 tones), Canadà (20 tones) i Zimbàbue i els Estats Units (12 tones cadascun).[4] No s'extreu dels minerals que el contenen en elevada proporció, sinó com a subproducte en l'obtenció d'altres elements (níquel, coure i zinc) en els quals minerals el pal·ladi és una impuresa.[2]
El creixent interès pel pal·ladi com a eina d'inversió ha portat a la seva cotització en borsa. Igual que succeeix amb l'or, l'argent i el platí, els lingots de pal·ladi estan codificats segons l'estàndard internacional de divises ISO 4217, que li assigna els codis XPD i 964.[5]
Propietats modifica
Propietats físiques modifica
El pal·ladi és un metall blanc argentat, semblant al platí, i és l'element del grup del platí de menor densitat (12,02 g/cm³) i menor punt de fusió (1 554,8 °C). El seu punt d'ebullició és de 2 963 °C. És bla i dúctil en temperar-lo, augmentant considerablement la seva duresa i resistència en treballar-lo en fred.[6]
Propietats químiques modifica
Els estats d'oxidació més comuns del pal·ladi són +2 i +4. No s'oxida amb l'aire. Per oxidar-lo cal escalfar-lo amb oxigen i dona l'òxid de pal·ladi(II) de color negre:[7]
Pot dissoldre's en àcid sulfúric, , i en àcid nítric, . També es pot dissoldre, encara que lentament, en àcid clorhídric, , en presència de clor o oxigen.[7]
Un control minuciós de la reacció entre el pal·ladi i el fluor , produeix el trifluorur de pal·ladi. Aquest compost no és fluorur de pal·ladi(III), sinó la sal de valència mixta de Pd(II, IV) que es formula com . El diclorur, clorur de pal·ladi(II), , també es forma en la reacció controlada entre el pal·ladi i el clor, . Depenent de les condicions de reacció, es forma una de les dues formes diferents de . En una reacció relacionada, el dibromur, el bromur de pal·ladi(II), , es forma en la reacció del pal·ladi i el brom, :[7]
El pal·ladi pot absorbir grans quantitats d'hidrogen molecular, , a temperatura ambient (fins a 900 vegades del seu volum), la qual cosa s'usa per a purificar-lo. Sembla que es forma .[8]
Isòtops modifica
Hi ha a la natura sis isòtops estables del pal·ladi, essent les seves abundàncies: 27,33 %, 26,46 %, 22,33 %, 11,72 %, 11,14 % i 1,02 %. Per altra banda, hi ha trenta-tres isòtops que s'han obtingut artificialment entre el nombre màssic 91 i el nombre màssic 128, vuit d'ells (del al ) com a fragments de la fissió nuclear de l'urani 235. Tots són poc estables, excepte el , amb un període de semidesintegració de 6,5 × 10⁶ anys, i el que el té de disset dies.[9]
Aplicacions modifica
Indústria química modifica
La principal aplicació del pal·ladi és la fabricació de convertidors catalítics, usats en el craqueig del petroli, i de catalitzadors d'automòbils, on es transformen les restes de combustible no cremat en diòxid de carboni, nitrogen i aigua.[10] El 77 % de la producció mundial fou destinat el 2017 a aquest sector industrial.[5]
El pal·ladi es fa servir com a reactiu en els reactors de membrana que s'empren en la producció d'hidrogen d'alta puresa. També el pal·ladi és un catalitzador important en l'eliminació de substàncies tòxiques dels aqüífers.[10]
El Premi Nobel de Química de l'any 2010 es concedí a Richard F. Heck (1931–2015), Ei-ichi Negishi (1935–2021) i Akira Suzuki (1930) per «la seva contribució al desenvolupament de mètodes sintètics catalitzats per complexos de pal·ladi, que han permès la preparació de milers de compostos orgànics d'estructures variades, útils en totes les àrees en les quals influeix la química». La concessió d'aquest guardó il·lustra la importància de la química organometàl·lica del pal·ladi.[5]
Indústria electrònica modifica
L'estabilitat química i la conductivitat elèctrica del pal·ladi el converteixen en una alternativa eficaç a la utilització de l'or en la producció de components electrònics, com els condensadors ceràmics de multicapa (MLCC) utilitzats en reproductors multimèdia i tauletes digitals, en les pistes conductores de pal·ladi i argent, en circuits integrats híbrids (HIC) o en connectors.[10] De la producció total de pal·ladi aproximadament un 9 % (2017) s'empra en la indústria electrònica.[5]
Tecnologia modifica
L'hidrogen es difon a través de pal·ladi fàcilment climatitzat, per la qual cosa proporciona un mitjà de purificar el gas.[6] És una part de l'elèctrode de pal·ladi-hidrogen en els estudis electroquímics; El clorur de pal·ladi (II) pot absorbir grans quantitats de monòxid de carboni, i s'utilitza en els detectors d'aquest gas.
Medicina modifica
El pal·ladi es fa ús en odontologia per a fabricar ponts i corones dentals, ja que proporciona resistència, rigidesa i durabilitat, i aliat amb argent esdevé més mal·leable.[10] En aquesta aplicació el 2017 s'hi destinà un 4 % de la producció mundial.[5]
El radioisòtop pal·ladi 103 es pot fer servir en el tractament del càncer de pròstata (braquiteràpia).[10]
Joieria modifica
El pal·ladi es combina amb l'or i l'argent per a fabricar l'aliatge anomenat or blanc. És un aliatge tou i adequada per encastar-hi pedres precioses.[10] El 2017 un 3 % del pal·ladi produït s'emprava en joieria.[5]
Emmagatzematge d'hidrogen modifica
L'hidrur de pal·ladi és un compost metàl·lic que conté una quantitat substancial d'hidrogen dins de la seva xarxa cristal·lina. A temperatura ambient i pressió atmosfèrica, el pal·ladi pot absorbir fins a 900 vegades el seu propi volum d'hidrogen en un procés reversible. Aquesta propietat ha estat investigada, i una millor comprensió del que passa a nivell molecular podria donar pistes sobre el disseny d'hidrurs de metall millorat.[11]
Fotografia modifica
Sovint s'utilitza amb el platí per imprimir fotos a blanc i negre, el pal·ladi proporciona una alternativa a la plata.[12]
Art modifica
El pal·ladi és una de diverses alternatives a la plata, que és utilitzada en la il·luminació de manuscrits. L'ús de la fulla de plata és problemàtica perquè entela ràpidament. El pal·ladi és un substitut adequat degut a la seva resistència a les taques. La fulla d'alumini és una alternativa més barata, però l'alumini és molt més difícil de treballar que l'or o la plata i els resultats són menys òptims amb l'ús de tècniques tradicionals del metall. que la fulla de pal·ladi es considera el millor substitut malgrat el seu cost considerable. El full de platí es pot utilitzar per al mateix efecte com el full de pal·ladi amb propietats de treball similars, però no és comercialment disponible per l'alta demanda del full.[13][14]
Referències modifica
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Lide, D. R. CRC Handbook of Chemistry and Physics (en anglès). 86a edició. CRC Press, 2005. ISBN 0-8493-0486-5.
- ↑ 2,0 2,1 2,2 2,3 Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ «Mineral Species sorted by the element Pd Palladium». [Consulta: 22 maig 2020].
- ↑ «Platinum Group Metals Data Sheet - Mineral Commodity Summaries 2020» (en anglès). National Minerals Information Center. U.S. Geological Survey, gener 2020. [Consulta: 22 maig 2020].
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Solé Arjó, D. «Z = 46, paladio, Pd. Un metal precioso con gran interés industrial y versatilidad catalítica». An. Quím., 115, 2, 2019, pàg. 108. Arxivat de l'original el 2020-02-07 [Consulta: 15 juny 2020].
- ↑ 6,0 6,1 Haynes, W.M.. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 93a edició. Boca Raton, Fla.: CRC Press, 2012. ISBN 978-1-4398-8049-4.
- ↑ 7,0 7,1 7,2 Winter, Mark. «WebElements Periodic Table » Palladium » reactions of elements». [Consulta: 16 juny 2020].
- ↑ Adams, Brian D.; Chen, Aicheng «The role of palladium in a hydrogen economy» (en anglès). Materials Today, 14, 6, 01-06-2011, pàg. 282–289. DOI: 10.1016/S1369-7021(11)70143-2. ISSN: 1369-7021.
- ↑ «Nudat 2» (en anglès). National Nuclear Data Center, Brookhaven National Laboratory. [Consulta: 22 maig 2020].
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. Universitat Politècnica de Catalunya, 2017. ISBN 978-84-9880-666-3.
- ↑ «Thermal Decomposition of the Non-Interstitial Hydrides for the Storage and Production of Hydrogen». Chemical Reviews, 104, 3, 2004, pàg. 1283–1316. 10.1021/cr030691s15008624.
- ↑ Ware, Mike «Book Review of : Photography in Platinum and Palladium». Platinum Metals Review, 49, 4, 2005, pàg. 190–195. 10.1595/147106705X70291.
- ↑ Morgan, Margaret. The Bible of Illuminated Letters. Barron's Educational Series, 2007.
- ↑ «Palladium Leaf».
Vegeu també modifica
Enllaços externs modifica
- webelements.com (anglès)
- It’s elemental (anglès)
- environmentalchemistry.com (anglès)
- Organic-chemistry.org (anglès)