Antimoni
L'antimoni és l'element químic de símbol Sb i nombre atòmic 51. Se situa en el grup 15 de la taula periòdica dels elements. El seu símbol prové del llatí stibium. L'antimoni i molts dels seus compostos són tòxics.
| Antimoni | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
51Sb
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||
Gris platejat brillant  Línies espectrals de l'antimoni | |||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||
| Nom, símbol, nombre | Antimoni, Sb, 51 | ||||||||||||||||||||||||
| Categoria d'elements | Metal·loides | ||||||||||||||||||||||||
| Grup, període, bloc | 15, 5, p | ||||||||||||||||||||||||
| Pes atòmic estàndard | 121,760(1) | ||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d10 5s2 5p3 2, 8, 18, 18, 5 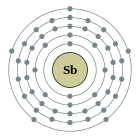
| ||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
6,697 g·cm−3 | ||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
6,53 g·cm−3 | ||||||||||||||||||||||||
| Punt de fusió | 903,78 K, 630,63 °C | ||||||||||||||||||||||||
| Punt d'ebullició | 1.860 K, 1.587 °C | ||||||||||||||||||||||||
| Entalpia de fusió | 19,79 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpia de vaporització | 193,43 kJ·mol−1 | ||||||||||||||||||||||||
| Capacitat calorífica molar | 25,23 J·mol−1·K−1 | ||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||
| Estats d'oxidació | 5, 3, -3 | ||||||||||||||||||||||||
| Electronegativitat | 2,05 (escala de Pauling) | ||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 834 kJ·mol−1 | ||||||||||||||||||||||||
| 2a: 1.594,9 kJ·mol−1 | |||||||||||||||||||||||||
| 3a: 2.440 kJ·mol−1 | |||||||||||||||||||||||||
| Radi atòmic | 140 pm | ||||||||||||||||||||||||
| Radi covalent | 139±5 pm | ||||||||||||||||||||||||
| Radi de Van der Waals | 206 pm | ||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||
| Estructura cristal·lina | Trigonal simple 
| ||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | ||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 417 nΩ·m | ||||||||||||||||||||||||
| Conductivitat tèrmica | 24,4 W·m−1·K−1 | ||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 11 µm·m−1·K−1 | ||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.420 m·s−1 | ||||||||||||||||||||||||
| Mòdul d'elasticitat | 55 GPa | ||||||||||||||||||||||||
| Mòdul de cisallament | 20 GPa | ||||||||||||||||||||||||
| Mòdul de compressibilitat | 42 GPa | ||||||||||||||||||||||||
| Duresa de Mohs | 3,0 | ||||||||||||||||||||||||
| Duresa de Brinell | 294 MPa | ||||||||||||||||||||||||
| Nombre CAS | 7440-36-0 | ||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||
| Article principal: Isòtops de l'antimoni | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Aquest element semimetàl·lic té dues formes al·lotròpiques. La seva forma estable és un metall blanc blavós. L'antimoni negre i el groc són formes no metàl·liques inestables. Principalment s'empra en aliatges metàl·lics i alguns dels seus compostos per a donar resistència contra el foc, en pintures, ceràmiques, esmalts, vulcanització del cautxú i focs d'artifici.
Etimologia modifica
El mot «antimoni» prové del baix llatí antimonium, i aquest de l'àrab iṯmid o uṯmud, i aquest de l'egipci smty.[2] Per altra banda, el símbol Sb prové del mot llatí stibium, i aquest del grec στίβι stíbi 'pols negre d'antimoni'. Al llibre Méthode de Nomenclature Chimique (1787), d'Antoine Lavoisier (1743-1794) i col., els químics Jean Henri Hassenfratz (1755-1827) i Pierre Auguste Adet (1763-1832) proposaren com a símbol de l'antimoni Sb dins d'un cercle a partir del nom en llatí ‘S’ti‘b’ium. Representaren tots els metalls amb la primera lletra en majúscula del nom en llatí. La lletra S ja havia estat emprada per simbolitzar l'estany (Stannum), per la qual cosa Hassenfratz i Adet afegiren una segona lletra del nom en minúscula, que no fou la t per no confondre amb l'estany.[3] El químic suec Jöns Jacob Berzelius (1779-1848) en la seva proposta del 1814[4] de simbolitzar tots els elements químics (metalls i no-metalls) amb la primera lletra del seu nom en majúscula i una segona en minúscula si coincidia la primera, representà l'antimoni tant amb el símbol St, de ‘St’ibium,[3] com amb Sb. Durant anys es feren servir ambdós, ja que en traduir-se els noms dels elements químics a diferents llengües també s'adaptaven els seus símbols. Finalment, durant ja el segle xx, la Unió Internacional de Química Pura i Aplicada (IUPAC) aconseguí fixar uns símbols únics i elegí el símbol Sb per a l'antimoni.[5]
Història modifica
L’antimoni és un dels pocs elements químics que ja eren coneguts pel món antic. Hi ha un gerro d'uns 5.000 anys al Museu del Louvre a París, que és gairebé el metall pur.[6]
Pigments modifica
També es feien servir alguns dels seus composts. El sulfur d’antimoni(III) s’esmenta en un papir egipci del segle xvi aC, i a partir d’aquella època la forma negra d’aquest pigment, que es produeix naturalment com el mineral estibina, s'emprava com a maquillatge d'ulls.[6] A la Bíblia apareix en diverses cites.[7] Per exemple la reina consort ‘Jehú va arribar a Jizreel. Jezabel, en saber-ho, es va maquillar els ulls, va arreglar-se el cap i es posà a la finestra’.[8] Quan el sulfur d’antimoni s'obté per precipitació, no és negre, sinó de color taronja i aquesta forma s’utilitzava per fer els caps de la llar al segle xix. Un altre pigment conegut per la civilització caldea, que florí al segle vi i al segle vii aC a la zona pantanosa de l'extrem sud-est de Mesopotàmia, fou un antimonat de plom groc . Es troba en el vidre dels maons ornamentals de la Babilònia del temps de Nabucodonosor II (604-561 aC). Aquest pigment s'emprà fins a mitjan segle xx i era conegut com a groc de Nàpols.[6]
Alquímia modifica
L'antimoni intrigà els alquimistes perquè s’assemblava a l’or en un aspecte, ja que només podia ser dissolt per l’aigua regia. Fou considerat el millor candidat per ser transmutat en or. El 1604 es publicà l’influent llibre Triumph-Wagen des Antimonii (El carro triomfal de l’antimoni), on es descrivien amb precisió molts composts d’antimoni. Aquest llibre fou escrit per un alquimista alemany, Johann Thölde, sota el pseudònim de Basilius Valentinus el 1400.[6]
El foc grec pot haver contingut sulfur d'antimoni(III). Aquest líquid incendiari era llançat des dels vaixells de guerra de l'armada bizantina i provocava terror als exposats perquè era impossible d'extingir i fins i tot es cremava a la superfície de l'aigua. La seva composició era secreta i un delicte capital revelar-la. S'emprà per última vegada l'any 1453 en la defensa final i infructuosa de la capital, Constantinoble. La composició més probable del foc grec era petroli cru, estibina i salnitre (nitrat de potassi ). Un cop s'encén, el sulfur d'antimoni(III) genera molta calor.[10]
Medicaments modifica
El metge grec Dioscòrides, que visqué a finals del segle i, en el seu llibre De Materia Medica (Els materials de la Medicina) recomanava el sulfur d'antimoni(III) o stibi, com es coneixia aleshores, per a les malalties de la pell i les cremades. El metge andalusí Abulcasis (Khàlaf ibn Abbàs az-Zahrawí), que morí el 1013, fou un dels primers a defensar l'ús del sulfur d'antimoni(III) com a medicament. L'antimoni es feu més popular cap al 1500 quan Paracels (1493-1541) defensà el seu ús per a tota mena de malalties. Petites dosis d'antimoni d'uns 5 mg produeixen sudoració abundant, mentre que dosis de 10 vegades aquesta quantitat provocaran vòmits, tots dos símptomes que es consideraven útils per tractar diverses queixes en èpoques més greus.[6] Un medicament popular era l'«emètic del tàrtar», que és el tartrat d'antimoni i potassi , que produeix vòmits ràpids i es considerava una manera d'expulsar els mals humors del cos. S'obtenia deixant una mica de vi durant la nit en una tassa feta d'antimoni. Al matí normalment havia dissolt prou metall per produir l'efecte desitjat.[10]
El 1609, el metge Oswald Croll (1580-1609) publicà Basilica Chymica (La basílica química) que contenia vint-i-tres receptes que incloïen antimoni, i especialment «mantega d'antimoni» (clorur d'antimoni(III) ). L'any 1657, el rei Lluís XIV de França, que tenia denou d'anys, emmalaltí de febre tifoide i fou tractat amb èxit amb òxid d'antimoni(III). La seva recuperació popularitzà aquest tipus de medicaments durant els dos-cents anys vinents i s'idearen tota mena de medicaments de composts d'antimoni. Un dels més populars per curar les «febres» era una mescla de fosfat de calci i òxid d'antimoni(III) . El vi d'antimoni, emprat a mitjan segle xviii com a tònic, per ajudar a aprimar i com a agent de sudoració, consistia en sulfur d'òxid d'antimoni dissolt en vi de Madeira.[6]
Alguns metges victorians i altres persones feren servir composts d'antimoni per assassinar les seves dones i familiars no desitjats. Els símptomes es disfressaren de trastorns gàstrics generals. També algunes morts accidentals s'han atribuït a l'antimoni, així el dramaturg francès Molière (1622-1673) estava convençut que el seu únic fill havia estat assassinat per un medicament que contenia antimoni. Una altra mort per excés d'antimoni pot haver estat la del compositor austríac Mozart (1756-1791).[10]
Hi hagué un renaixement de l'interès per les sals d'antimoni per part de metges i veterinaris a principis del segle xx en descobrir-se, el 1915, que era eficaç contra les infeccions parasitàries: infeccions com la bilhàrzia, la triquinosi i l'esquistosomosi. S'empraven dosis que mataven els paràsits però insuficients per enverinar el pacient. El medicament donat era com una molècula complexa coneguda com a estibofè, i s'injectava diàriament durant diversos dies; la quantitat d'antimoni lliurada era d'uns 500 mg. Les persones tractades d'aquesta manera tenien nivells més alts d'antimoni a la sang i l'orina durant molts mesos per la dificultat d'excretar-lo.[10]
Abundància i obtenció modifica
Les estimacions sobre l'abundància d'antimoni en l'escorça terrestre van des de 0,2 a 0,5 ppm, ocupant la posició 63a quant a abundància dels elements químics. En els sols la mitjana és d'1 ppm i a l'aigua de la mar 0,3 ppb. A l'atmosfera només se'n detecten traces però la seva concentració s'incrementa pel seu ús antròpic.[10]
L'antimoni es troba en la naturalesa en dos-cents seixanta-quatre minerals, encara que és un element poc abundant. És possible trobar-lo lliure, però normalment està en forma de sulfurs essent el més important l'estibita . També s'atribueix cert valor econòmic a la quermesita , la tetraedrita argentífera , la livingstonita i la jamesonita .[11] Els minerals que el contenen en més d'un 80 % són: paradocrasita 91,92 %, senarmontita 88,39 %, kieftita 86,11 %, valentinita 83,53 % i nisbita 80,58 %.[12]
La Xina fou el principal productor mundial d'antimoni l'any 2022 amb 60.000 t, un 55 % de la producció minera mundial (110.000 t). Li seguiren Rússia (20.000 t), Tadjikistan (17.000 t), Myanmar (4.000 t), Austràlia (4.000 t), Bolivia (2.500 t) i d'altres en quantitats més baixes. Les reserves mundials d'antimoni es calculen en més d'1,8 milions de tones, principalment a la Xina, Rússia, Bolívia i Kirguizstan.[13]
Per mitjà de la torrada de l'estibina s'obté òxid d'antimoni(III) , que es pot reduir amb carbó de coc per a l'obtenció d'antimoni.[14]
També es pot obtenir per reducció directa del sulfur, per exemple amb ferralla de ferro:
Propietats modifica
Propietats físiques modifica
L'antimoni en la seva forma elemental és un sòlid cristal·lí, fusible, trencadís, blanc argentat amb un punt de fusió de 630,63 °C, un punt d'ebullició de 1.587 °C i una densitat a 20 °C de 6,68 g/cm³. Presenta una conductivitat elèctrica i tèrmica baixa i s'evapora a baixes temperatures. Aquest element semimetàl·lic s'assembla als metalls en el seu aspecte i propietats físiques, però no es comporta químicament com un metall. Existeixen dues formes al·lotròpiques d'antimoni: la forma normal, estable, metàl·lica, i la forma grisa amorfa. L'anomenat «antimoni explosiu» és un material mal definit que conté sempre una quantitat apreciable d'halogen; per tant, ja no mereix ser considerat com un al·lòtrop separat. La forma groga, obtinguda per oxidació de l'hidrur d'antimoni(III) o estibà , és probablement impura i no és una forma diferent.[15]
Propietats químiques modifica
La configuració electrònica de l'antimoni és [Kr]4d105s25p³ i els seus estats d'oxidació més comuns són el +3 i el +5, malgrat que també pot presentar el −3 i, evidentment, el 0.[15]
En escalfar-se, l'antimoni reacciona amb l'oxigen de l'aire per formar el triòxid d'òxid d'antimoni(III) amb una flama de color blanc blavós. La reacció és:[16]
També s'obté el mateix òxid amb despreniment d'hidrogen si l'antimoni reacciona amb l'aigua. La reacció és lenta a temperatura ambient i augmenta de velocitat amb la temperatura:[16]
L'antimoni reacciona en condicions controlades amb els halògens per formar els respectius trihalurs fluorur d'antimoni(III) , clorur d'antimoni(III) , bromur d'antimoni(III) i iodur d'antimoni(III) .[16] També es forma el fluorur f'antimoni(V) i el clorur d'antimoni(V) .[18]
Amb els calcògens l'antimoni produeix del sulfur d'antimoni(III), el selenur d'antimoni(III) i el tel·lurur d'antimoni(III). Com a exemple la reacció amb el sofre és:[18]
L'antimoni es dissol en àcid sulfúric concentrat calent , o àcid nítric , per formar solucions que contenen cations antimoni(3+). La reacció de l'àcid sulfúric produeix diòxid de sofre. L'antimoni no reacciona amb l'àcid clorhídric en absència d'oxigen.[16] Tampoc reacciona amb les bases.[18]
Isòtops modifica
Hom troba l'antimoni a la natura en forma de dos isòtops estables: l'antimoni 121 és el majoritari amb una abundància del 57,36 % i el minoritari és l'antimoni 123 amb un 42,64 %. S'han identificat trenta-cinc radioisòtops, dels quals el que té un període de semidesintegració més llarg, t½ = 2,75 anys, és l'antimoni 125. També s'han caracteritzat vint-i-nou estats metaestables, essent l'antimoni 120m1 el que té una semivida més llarga t½ = 5,76 dies. Els radionúclids més lleugers que l'antimoni 123 decauen per emissió β+, mentre que el més pesant ho fan per emissió β−, amb algunes excepcions.[20] Exemples:
Aplicacions modifica
Indústria química modifica
El principal ús de l'antimoni, en concret l'òxid d'antimoni(III) , és la producció de retardants de flama usats en pintures, coles, plàstics (per a cobertes d'ordinadors i televisors, entre d'altres) i en el tractament de teixits ignífugs (telons de teatre). Tot i que l'òxid antimoni(III) no és un retardant per si mateix, quan es combina amb halògens (com el brom) en els polímers, la barreja resultant suporta i redueix la propagació de les flames.[21]
També s'utilitza l'òxid d'antimoni(III) com a catalitzador en la fabricació de plàstics (PET per a ampolles d'aigua i d'altres).[22]
Indústria de bateries modifica
Els aliatges d’antimoni i plom (entre l'1 % i el 10 % d'antimoni) proporcionen propietats elèctriques millorades a les bateries. Els elèctrodes de bateries recoberts amb aliatges de plom tenen una recàrrega més eficient i es poden drenar plenament en diverses ocasions amb un rendiment sostingut. Molts telèfons mòbils fan servir bateries que porten antimoni.[21]
Indústria electrònica modifica
L'antimoni puríssim es fa servir en la fabricació de semiconductors.[22]
Indústria metal·lúrgica modifica
L'antimoni aliat amb l'estany s'usa en soldadures, i aliat amb el zinc aporta duresa a l'aliatge. La munició feta amb aliatges de plom d’antimoni (entre l'1 % i el 10 % d'antimoni) és capaç de penetrar diferents armadures.[21] El metall de Britània és un aliatge format per aproximadament un 90 % d'estany i un 10 % d'antimoni. És un metall blanc de laminació, fusió i emmotllament fàcils, i susceptible d'ésser reduït a filament.[23]
Altres camps modifica
La indústria de la ceràmica, dels plàstics i de les gomes industrials consumeixen sals d’antimoni.[22]
En medicina, s'empra per a tractar la leishmaniosi, infecció parasitària és causada per un protozou que envaeix la pell; és una malaltia infantil molt estesa als països càlids, que es transmet per mosquits de la sorra. El millor tractament és amb gluconat de sodi d'antimoni, comercialment conegut com a Pentostam.[24][25]
El sulfur d'antimoni(III) s'utilitza en focs artificials, en certs tipus de llumins, com a pigment (negre, vermell, groc, taronja) i en la fabricació de vidre de robí.[26] Les pintures de camuflatge contenen sulfur d'antimoni(III), que reflecteix la radiació infraroja.[27] També s'empra com a lubricant industrial.[21]
Toxicitat modifica
Les persones que han pres una gran dosi d'antimoni accidentalment han patit vòmits, després han semblat recuperar-se i finalment han mort al cap d'uns dies. Les intoxicacions massives s'han produït quan es preparaven begudes de fruita en recipients d'esmalt, dels quals s'ha lixiviat l'antinomi, encara que poques vegades amb conseqüències fatals. L'antimoni s'uneix a enzims particulars a causa de la seva atracció pels àtoms de sofre al lloc actiu dels enzims. Un cop unit, no es pot desallotjar fàcilment. Molt més mortal és l'estibà .[28]
Referències modifica
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press (en anglès)
- ↑ «antimoni». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana. [Consulta: 3 març 2023].
- ↑ 3,0 3,1 K.J. Thurlow. Chemical Nomenclature. Dordrecht: Springer, 1998. ISBN 978-94-011-4958-7.
- ↑ Berzelius, J.J. «Essay on the Cause of Chemical Proportions, and on Some Circumstances Relating to Them; Together with a Short and Easy Method of Expressing Them». Annals of Philosophy, 3, 1814, pàg. 51-62, 93–106, 244–257, 353–364.
- ↑ Meija, Juris «Symbols of the Elements, Part II» (en anglès). Chemistry International, 36, 3, 01-05-2014, pàg. 18–20. DOI: 10.1515/ci.2014.36.3.18. ISSN: 1365-2192.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 Emsley, John. Nature's building blocks : an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ «Eye Paint - Encyclopedia of The Bible - Bible Gateway» (en anglès). [Consulta: 2 març 2023].
- ↑ biblia2Re 9:30
- ↑ McElroy, D. R.. Signs & symbols of the world : over 1,001 visual signs explained, 2020. ISBN 978-0-7603-6578-6.
- ↑ 10,0 10,1 10,2 10,3 10,4 Emsley, John. Nature's Building Blocks: an a-Z Guide to the Elements.. 2a edició. Oxford: Oxford University Press, Incorporated, 2011. ISBN 978-0-19-257046-8.
- ↑ «Antimoni» (en anglès). Encyclopædia Britannica, 2003.
- ↑ «Mineral Species sorted by the element Sb Antimony». [Consulta: 3 març 2023].
- ↑ «Antimony Statistics and Information | U.S. Geological Survey» (en anglès). [Consulta: 3 març 2023].
- ↑ Hiorns, Arthur Horseman. Practical metallurgy and assaying: a text-book for the use of teachers, students, and assayers. Macmillan, 1906.
- ↑ 15,0 15,1 W.M. Haynes. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 95a edició. Boca Raton, Florida: CRC Press, 2014. ISBN 978-1-4822-0867-2.
- ↑ 16,0 16,1 16,2 16,3 Winter, Mark. «WebElements Periodic Table » Antimony » reactions of elements». Webelements. [Consulta: 6 març 2023].
- ↑ De, Anil K. A textbook of inorganic chemistry. Ninth edition, thoroughly recast and enlarged, 2003. ISBN 978-81-224-1384-7.
- ↑ 18,0 18,1 18,2 Smith, J. D.. The Chemistry of Arsenic, Antimony and Bismuth: Pergamon Texts in Inorganic Chemistry., 2016. ISBN 978-1-4831-4006-3.
- ↑ Farrell, Ian. «What’s the strongest acid in the world?» (en anglès). Royal Society of Chemistry, 21-10-2021. [Consulta: 7 març 2023].
- ↑ Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. «The Nubase evaluation of nuclear and decay properties» (en anglès). Nuclear Physics A, 729, 1, 2003-12, pàg. 3–128. DOI: 10.1016/j.nuclphysa.2003.11.001.
- ↑ 21,0 21,1 21,2 21,3 Wintzer, Niki E.; Guberman, David E. «Antimony: a flame fighter». USGS Mineral Resources Program [Reston, VA], 2015, pàg. 2. DOI: 10.3133/fs20153021.
- ↑ 22,0 22,1 22,2 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ «Antimoni». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «★ PENTOSTAM Solution for injection 10 g/100 ml de Arabia Saudí 🥇». [Consulta: 7 març 2023].
- ↑ Ausina Ruiz, Vicente; Moreno Guillén, Santiago. Tratado SEIMC de enfermedades infecciosas y microbiología clínica. Madrid: Editorial Médica Panamericana, 2006. ISBN 84-7903-921-3.
- ↑ Freedman, L.D. [et al.].. Kirk-Othmer. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, 2007. DOI 10.1002/0471238961.0114200906180505.a01.
- ↑ Li, T. Kirk-Othmer. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, 2007. DOI 10.1002/0471238961.011420091209.a01.
- ↑ Encyclopedia of toxicology. 2a edició. Oxford: Elsevier, 2005. ISBN 978-0-12-369400-3.
Vegeu també modifica
Enllaços externs modifica
- Los Alamos National Laboratory - Antimoni Arxivat 2004-02-20 a Wayback Machine. (anglès)
- webelements.com - Antimoni (anglès)
- environmentalchemistry.com - Antimoni (anglès)
- Etimologia i multidiccionari - Antimoni (anglès)