Bari (element)
El bari és l'element químic de símbol Ba i nombre atòmic 56. Està situat al 6è període i al grup 2 dels alcalinoterris. L'element s'empra en metal·lúrgia i els seus composts en radiologia, en la producció de petroli i en pirotècnia.[1]
| Bari | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
56Ba
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris platejat Bari sota atmosfera de gas inert d'argó  Línies espectrals del bari | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Bari, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls alcalinoterris | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 2, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 137,33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 6s2 2, 8, 18, 18, 8, 2 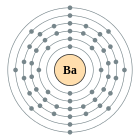
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
3,51 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
3,338 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.000 K, 727 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 2.170 K, 1.897 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 7,12 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 140,3 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 28,07 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | +2 (òxid bàsic fort) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 0,89 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 502,9 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 965,2 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.600 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 215±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 332 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 18,4 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 20,6 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 1.620 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 9,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 1,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del bari | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Història
modificaEl sulfat de bari es presenta de manera natural en el mineral barita i fou investigat per primera vegada a principis del segle xvii per Vincenzo Casciarolo (1571-1624), un sabater que es dedicava a l'alquímia. Casciarolo trobà uns còdols brillants a prop de casa seva a Bolonya, Itàlia. Escalfà aquestes pedres fins a envermellir i observà una propietat força curiosa: brillaven a la foscor. De fet, sempre que estigués exposada al sol durant el dia, la «pedra de Bolonya», com es conegué, brillava durant força temps la nit següent. Un altre italià, Ulisse Aldrovandi (1522–1605), publicà un relat del fenomen i així ho posà en coneixement d'un públic més ampli.[2]
Ja al segle xviii, el 1774 el químic suec Carl Wilhelm Scheele (1742–1786) descobrí una nova base, la barita o òxid de bari , com a component menor del mineral pirolusita, i a partir d'aquesta base preparà alguns cristalls de sulfat de bari, que envià al seu col·laborador el químic suec Johan Gottlieb Gahn (1745–1815), que havia descobert el manganès. Un mes després, Gahn trobà que el mineral baritina també estava compost per sulfat de bari.[3]
Mentrestant, el mineralogista William Withering (1741–1799) havia trobat un altre mineral curiosament pesat en una mina de plom a Cumberland, Anglaterra, que clarament no era un mineral de plom. L'anomenà en llatí terra ponderosa i, més tard, es demostrà que era carbonat de bari , i ara el mineral s'anomena witherita.[2]
Només després que la bateria elèctrica estigués disponible a principis del segle xix, el químic anglès Humphry Davy (1778-1829) finalment aconseguí el 1808 aïllar l'element per electròlisi d'hidròxid de bari fos, a la Royal Institution, a Londres.[4] El seu nom deriva del mineral baritina o barita, i aquest del grec βαρύς barýs «pesant».[3]
Estat natural
modificaEl bari és un element químic abundant, ordenats els elements per abundància ocupa la posició 14, amb una concentració mitjana a l'escorça terrestre de 500 ppm. També se'l troba dissolt en les aigües, l'oceà Atlàntic en té una concentració de 10 ppb i el Pacífic de 20 ppb.[2]
A la naturalesa hom troba el bari en molts de minerals. Els que en contenen més d'un 50 % són: frankdicksonita 78,33 %, zhangpeishanita 71,21 %, witherita 65,29 %, alforsita 68,19 %, baritina 58,84 %, radiobaritina 58,83 %, barioperovskita 58,18 %, hashemita 55,30 %, muirita 54,36 %, fresnoïta 54,20 %, babeffita 52,91 %, nitrobarita 52,55 %, kampfita 50,96 % i sanbornita 50,21 %.[5]
No s'ha descobert cap funció biològica del bari, tot i que per a algunes espècies sembla que és essencial. Ja a la dècada de 1770 es detectà a la cendra de plantes i hortalisses, i el 1865 es trobà que estava present en algues i algunes espècies marines. Per la seva abundància no és d'estranyar trobar-lo en els aliments fins al punt que probablement hom en consumeix al voltant d'1 mg/dia. Com que aquest element és tan semblant al calci, hom n'absorbeix una part, malgrat que no serveix per res útil.[2]
Les plantes alimentàries que contenen més bari són pastanagues (13 ppm pes sec), cebes (12 ppm), enciam (9 ppm), mongetes (8 ppm) i grans de cereals (6 ppm). Mentre que les que en contenen menys són fruites com la poma (1 ppm) i la taronja (3 ppm). Alguns estudis indiquen que les llavors de la noguera del Brasil (Bertholletia excelsa) poden tenir-ne fins a 10 000 ppm (1 %).[2]
Obtenció
modificaEl mineral més abundant és la baritina , d'on se l'extreu, i també de la witherita . La producció anual, el 2019, fou de 9 500 milions de tones (Mt) de baritina, essent els principals productors: la Xina 2900 Mt, l'Índia 2200 Mt, el Marroc 1100 Mt, Kazakhstan 620 Mt, Iran 490 Mt, Laos 420 Mt i Mèxic 400 Mt.[6] S'ha calculat que les reserves de bari superen els 400 milions de tones.[2]
La producció comercial del bari depèn de l'electròlisi del clorur de bari fus, però el mètode més eficaç és la reducció de l'òxid de bari escalfant-lo amb alumini o silici en un buit elevat. També es pot utilitzar una barreja d'òxid de bari i peròxid de bari .[4]
Propietats
modificaPropietats físiques
modificaEl bari és un metall del grup dels alcalinoterris, que té una densitat de 3,51 g/cm³, un punt de fusió de 727 °C i un punt d'ebullició de 1870 °C.[7] La seva estructura cristal·lina és cúbica centrada en el cos. És blan (duresa 1,25 en l'escala de Mohs), lleugerament més dur que el plom. Té una brillantor blanca argentada quan se'l talla.[4]
Propietats químiques
modificaLa superfície de bari metall està coberta amb una fina capa d'òxid que ajuda a protegir el metall de l'atac de l'aire, però en menor mesura que la capa corresponent del magnesi. Un cop encès, el metall de bari es crema a l'aire per donar una barreja d'òxid de bari, i nitrur de bari, . L'òxid de bari es produeix més normalment escalfant el carbonat de bari . Aparentment, el superòxid de bari també es forma en aquesta reacció. El bari, tres llocs per sota del magnesi a la taula periòdica, és més reactiu amb l'aire que el magnesi.[8]
El bari reacciona fàcilment amb l'aigua per formar hidròxid de bari i gas hidrogen . La reacció és més ràpida que la d'estronci (immediatament per sobre del bari a la taula periòdica), però probablement més lenta que la del radi (immediatament per sota del bari a la taula periòdica).[8]
El clor, el brom i el iodem reaccionen per formar clorur de bari , bromur de bari i iodur de bari , respectivament. Les reaccions amb brom i amb iode probablement requereixen calor.[8]
Isòtops
modificaEl bari natural és una barreja de sis isòtops estables: bari 138 (71,7 %), bari 137 (11,2 %), bari 136 (7,8 %), bari 135 (6,6 %), bari 134 (2,4 %) i bari 132 (0,10 %). El bari 130 (0,11 %) també es produeix de manera natural, però experimenta una desintegració radioactiva mitjançant una doble captura d'electrons amb un període de semidesintegració extremadament llarg, de més de 4×1021 anys, i també se'l pot considerar a la pràctica estable. Per altra banda, es coneixen més de 30 radioisòtops de bari, amb un nombre màssic que varia entre 114 i 153. El radioisòtop bari 133 té el període de semidesintegració més alt, 10,5 anys, i s'empra com a font de referència de la radiació gamma.[4]
Aplicacions
modificaMedicina
modificaEn l'ènema de bari, un procediment mèdic que s'usa per a examinar la part inferior de l'aparell digestiu, al pacient se li administra un preparat amb sulfat de bari que recobreix la capa interior de l'intestí i s'utilitza com a agent de contrast radiològic. Durant la radiografia, el revestiment de sulfat de bari absorbeix bona part dels raigs X i posa de manifest les zones lesionades.[9]
Indústria química
modificaEl sulfat de bari es fa servir com a additiu en l'elaboració de cautxú (guants, joguines, pneumàtics i gomes d'esborrar) per a augmentar-ne l'elasticitat. S'empra també en la producció de llots de perforació per a lubricar l'eina de perforació i millorar la sostenibilitat de les parets dels pous d'extracció de petroli, gas i aigua. Mesclat amb sulfur de zinc en proporcions semblants dona el pigment blanc conegut com a litopó o blanc de zinc, que s'utilitza en pintures i esmalts per a obtenir recobriments que no s'enfosqueixin en contacte amb sulfurs. Es fa ús en la producció de paper-cartolina perquè hi aporta resistència i densitat. S'usa com additiu en la preparació de formigons baritats, que s'utilitzen en la construcció dels murs i laberints dels acceleradors lineals, per a evitar la fuga de radiacions.[9]
El nitrat de bari i el clorat de bari s'empren per generar el color verd als focs d'artifici i a les bengales.[2]
El peròxid de bari es fa servir en el blanqueig de substàncies animals, fibres vegetals i palla; com a decolorant del vidre; en la producció de peròxid d'hidrogen i oxigen ; en càtodes de làmpades fluorescents; per a tenyir i imprimir tèxtils; amb alumini en pols en soldadura; en composicions d'ignífers; com a agent oxidant en síntesi de química orgànica.[10]
Indústria del vidre i la ceràmica
modificaEl carbonat de bari s'utilitza en la fabricació del vidre, ja que n'augmenta l'índex de refracció i la lluïssor.[9] Del carbonat s'obté el titanat de bari , compost útil en la fabricació de ceràmiques amb propietats dielèctriques elevades.[7]
Toxicitat
modificaEl bari té una mobilitat limitada al medi, ja que tendeix a formar compostos insolubles en condicions comunes de la superfície terrestre i no forma complexos orgànics solubles. El bari alliberat dels minerals durant la intempèrie tendeix a precipitar-se com a sulfat de bari (mineral baritina), com a carbonat de bari (mineral witherita) o altres minerals o a adsorbir-se sobre minerals d'argila, òxids o hidròxids. La barita és pràcticament insoluble en ambients oxidants i és altament resistent a la intempèrie. La solubilitat de la majoria de compostos de bari augmenta a mesura que les condicions es tornen reduïdes o àcides.[11]
No hi ha proves d'efectes toxicològics adversos del bari en plantes o vida salvatge a prop de mines de baritina o en altres llocs. El bari només s'acumula lleugerament de sòl a planta i de planta a animal; tanmateix, s'ha demostrat que els alts continguts de bari del sòl inhibeixen el creixement d'algunes plantes terrestres.
El bari pot estimular el metabolisme fins al punt que farà que el cor batega de manera irregular (fibril·lació ventricular). Les seves sals solubles són perillosament tòxiques si es prenen. Els símptomes de la intoxicació per bari són vòmits, còlics, diarrea, tremolors i paràlisi.[2]
Als Estats Units, s'ha proposat una pauta de detecció de sòls de 500 ppm per a la fitotoxicitat, però aquesta referència només té dades limitades per suportar-la. Alguns compostos de bari solubles són tòxics per als animals; per exemple, el carbonat de bari , el mineral witherita, tot i que és insoluble en aigua, és tòxic perquè es dissol en l'àcid de l'estómac, i s'ha emprat com a rodenticida.[11]
Referències
modifica- ↑ «bari». Gran Enciclopèdia Catalana. Arxivat de l'original el 2024-03-04. [Consulta: 15 octubre 2023].
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5. Arxivat 2020-12-15 a Wayback Machine.
- ↑ 3,0 3,1 Challoner, Jack. Los elementos. La nueva guía de los componentes básicos del universo. (en castellà). Alcobendas: Libsa, 2018, p. 36. ISBN 9788466236669.
- ↑ 4,0 4,1 4,2 4,3 «Barium | chemical element» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 24-01-2018. Arxivat de l'original el 2020-05-05. [Consulta: 6 març 2020].
- ↑ «Mineral Species sorted by the element Ba Barium». Arxivat de l'original el 2020-03-08. [Consulta: 6 març 2020].
- ↑ «Barite Statistics and Information». Arxivat de l'original el 2021-11-30. [Consulta: 9 març 2020].
- ↑ 7,0 7,1 Poblet Rius, J.M. «Z = 56, bario, Ba. Elemento muy reactivo que se encuentra en la naturaleza en forma de minerales muy densos». An. Quim., 115, 2, 2019, pàg. 118. Arxivat de l'original el 2020-02-07 [Consulta: 6 març 2020]. Arxivat 2020-02-07 a Wayback Machine.
- ↑ 8,0 8,1 8,2 «WebElements Periodic Table » Barium » reactions of elements». Arxivat de l'original el 2020-03-17. [Consulta: 9 març 2020].
- ↑ 9,0 9,1 9,2 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3. Arxivat 2024-05-16 a Wayback Machine.
- ↑ PubChem. «Barium peroxide» (en anglès). Arxivat de l'original el 2020-09-07. [Consulta: 6 març 2020].
- ↑ 11,0 11,1 Johnson, C.A.; Piatak, N.M.; Miller, M.M.. «Barite (Barium)». A: Klaus J. Schulz, John H. DeYoung, Jr., Robert R. Seal II, i Dwight C. Bradley. Critical Mineral Resources of the United States—Economic and Environmental Geology and Prospects for Future Supply. Reston, Virginia: US Department of the Interior i US Geological Survey, 2017.
Enllaços externs
modifica- webelements.com - Bari (anglès).
- environmentalchemistry.com - Bari (anglès).