Potassi
El potassi és l'element químic de símbol K i nombre atòmic 19. És un metall blanc argentat tan tou que es pot tallar amb un ganivet sense dificultat. Té un baix punt de fusió i és bon conductor tèrmic i de l'electricitat.[1]
| Potassi | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
19K
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||
Gris argentat Perles de potassi en oli de parafina (la grossa fa 0,5 cm)  Línies espectrals del potassi | |||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Potassi, K, 19 | ||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls alcalins | ||||||||||||||||||||||||||||||
| Grup, període, bloc | 1, 4, s | ||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 39,0983(1) | ||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s1 2, 8, 8, 1 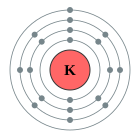
| ||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
0,862 g·cm−3 | ||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
0,828 g·cm−3 | ||||||||||||||||||||||||||||||
| Punt de fusió | 336,53 K, 63,38 °C | ||||||||||||||||||||||||||||||
| Punt d'ebullició | 1.032 K, 759 °C | ||||||||||||||||||||||||||||||
| Punt triple | 336,35 K (63 °C), kPa | ||||||||||||||||||||||||||||||
| Entalpia de fusió | 2,33 kJ·mol−1 | ||||||||||||||||||||||||||||||
| Entalpia de vaporització | 76,9 kJ·mol−1 | ||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 29,6 J·mol−1·K−1 | ||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||
| Estats d'oxidació | 1 (òxid bàsic fort) | ||||||||||||||||||||||||||||||
| Electronegativitat | 0,82 (escala de Pauling) | ||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 418,8 kJ·mol−1 | ||||||||||||||||||||||||||||||
| 2a: 3.052 kJ·mol−1 | |||||||||||||||||||||||||||||||
| 3a: 4.420 kJ·mol−1 | |||||||||||||||||||||||||||||||
| Radi atòmic | 227 pm | ||||||||||||||||||||||||||||||
| Radi covalent | 203±12 pm | ||||||||||||||||||||||||||||||
| Radi de Van der Waals | 275 pm | ||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| ||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnetic | ||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 72 nΩ·m | ||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 102,5 W·m−1·K−1 | ||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 83,3 µm·m−1·K−1 | ||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 2.000 m·s−1 | ||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 3,53 GPa | ||||||||||||||||||||||||||||||
| Mòdul de cisallament | 1,3 GPa | ||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 3,1 GPa | ||||||||||||||||||||||||||||||
| Duresa de Mohs | 0,4 | ||||||||||||||||||||||||||||||
| Duresa de Brinell | 0,363 MPa | ||||||||||||||||||||||||||||||
| Nombre CAS | 7440-09-7 | ||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||
| Article principal: Isòtops del potassi | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
És abundant en la natura, per exemple a l'aigua de mar (que conté un 0,04% de potassi en massa[2]) o en minerals diversos, com l'ortosa. S'oxida ràpidament en l'aire, és molt reactiu, especialment en aigua, i s'assembla químicament al sodi. És un element químic essencial per a la vida. Té un rol fonamental en la propagació dels impulsos nerviosos. La principal aplicació industrial del potassi és el seu ús en la fabricació d'adobs. Altres usos aprofiten l'elevada solubilitat aquosa dels compostos de potassi, per exemple, per a la fabricació de sabons.[3]
Característiques principals
modificaÉs el segon metall més lleuger; és un sòlid tou que es talla amb facilitat amb un ganivet,[4] té un punt de fusió molt baix i crema amb flama violeta. Presenta un color argentat en les superfícies exposades a l'aire, ja que s'oxida amb rapidesa, cosa que obliga a emmagatzemar-lo recobert d'oli.[5]
De la mateixa manera que altres metalls alcalins reacciona violentament amb l'aigua desprenent hidrogen i, fins i tot, pot inflamar-se espontàniament en presència d'aigua.
Aplicacions
modifica- El potassi metall s'usa en cèl·lules fotoelèctriques.
- El clorur de potassi i el nitrat de potassi s'empren com fertilitzants.
- El peròxid de potassi s'usa en aparells de respiració autònoms de bombers i miners.
- El nitrat s'usa en la fabricació de pólvora i el cromat i dicromat en pirotècnia.
- El carbonat de potassi s'empra en la fabricació de vidres.
- L'aliatge NaK, un aliatge de sodi i potassi, és un material emprat per a la transferència de calor.
- El clorur de potassi s'utilitza per a provocar una aturada cardíaca en les execucions amb injecció letal.
Altres sals de potassi importants són el bromur, cianur, potassi, iodur, i el sulfat.
Paper biològic
modificaPotassi al cos
modificaEl catió K+ està present en els extrems dels cromosomes, anomenats telòmers, estabilitzant-ne l'estructura. Així mateix, l'ió hexahidratat, igual que el corresponent ió de magnesi, estabilitza l'estructura de l'ADN i de l'ARN compensant la càrrega negativa dels grups fosfat.
La bomba de sodi és un mecanisme pel qual s'aconsegueixen les concentracions requerides d'ions K+ i Na+ dins i fora de la cèl·lula —concentracions d'ions K+ més altes dins de la cèl·lula que en l'exterior— per a possibilitar la transmissió de l'impuls nerviós.
El descens del nivell de potassi a la sang provoca hipopotassèmia. Les hortalisses (remolatxa, coliflor) i fruites (especialment les de pinyol com l'albercoc, cirera, pruna, bresquilla, etc.) són aliments rics en potassi.
Absorció, filtració i excreció
modificaEl potassi és absorbit de forma ràpida des de l'intestí prim. Entre 80 i 90% del potassi ingerit és excretat a l'orina, la resta és perdut en la femta. Els ronyons mantenen els nivells normals de potassi en sèrum a través de la seva habilitat de filtrar, reabsorbir i excretar potassi sota la influència de l'hormona aldosterona.[6] Conjuntament amb el sodi, tots dos regulen el balanç entre fluids i electròlits a l'organisme, ja que són els principals cations del líquid intracel·lular (potassi) i extracel·lular (sodi) dels fluids corporals totals de l'organisme. La concentració del sodi al plasma és prop de 145 meq/L, mentre que la del potassi és de 3,5 a 4,5 meq/L (en plasma). El plasma és filtrat a través dels glomèrul dels ronyons en quantitats enormes, prop de 180 L/dia.[7] Diàriament el sodi i potassi ingerit a la dieta ha de ser reabsorbit; el sodi ha de ser reabsorbit tant com sigui necessari per mantenir el volum del plasma i la pressió osmòtica correctament, mentre que el potassi ha de ser reabsorbit per mantenir les concentracions sèriques del catió en 4,8 meq/L (prop de 190 mil·ligrams). La bomba de sodi s'ha de mantenir sempre operativa per conservar el sodi. El potassi ha de ser conservat algunes vegades, però atès que les quantitats de potassi en plasma són tan petites, i la concentració de potassi a nivell cel·lular és prop de tres vegades més gran, la situació no és tan crítica per al potassi. Atès que el potassi es transporta passivament[8][9] en resposta a un flux contrari al sodi, l'orina mai no pot disminuir les concentracions de potassi en sèrum, excepte algunes vegades on s'observi una excreció activa d'aigua. El potassi és doblement secretat i reabsorbit tres vegades abans que l'orina arribi als túbuls col·lectors del ronyó.[10] A aquest punt usualment s'assoleix la mateixa concentració en plasma. Si el potassi fos eliminat de la dieta, obligaria el ronyó a una excreció mínima de potassi al voltant de 200 mg/dia quan el potassi en sèrum decline a 3,0 meq/L en una setmana aproximadament.[11] La bomba de sodi/potassi és un mecanisme pel qual s'aconsegueixen les concentracions requerides d'ions K+ i Na+ dins i fora de la cèl·lula —concentracions d'ions K+ més altes dins la cèl·lula que a l'exterior— per possibilitar la transmissió de l'impuls nerviós.
Potassi a la dieta
modificaLa ingesta adequada de potassi pot ser generalment garantida en consumir una varietat d'aliments que continguin potassi, i la deficiència és molt rara en individus que consumeixin una dieta equilibrada. Els aliments que són font alta de potassi inclouen: les hortalisses (patata, bròquil, remolatxa, albergínia i coliflor) i les fruites (els plàtans) i les de pinyol (com els raïms, albercoc, préssec, cirera, pruna, etc.), són aliments rics en potassi.[12] El potassi és el tercer mineral més abundant al nostre cos. Està implicat en la reacció dels nervis, en el moviment muscular i en el manteniment saludable.
Els aliments que tenen més potassi són les mongetes, que aporten 1.300 mg de potassi c/ 100 g; el germen de blat, que aporta uns 842 mg de potassi c/ 100 g; l'alvocat, que aporta 600 mg c/ 100 gram; la soja aporta 515 mg c/ 100 g; les nous, que aporten 441 mg de potassi c/ 100 g; la patata, que aporta 421 mg de potassi c/ 100 g, i el plàtan, que aporta 396 mg c/ 100 g.[13]
Les dietes altes en potassi poden reduir el risc d'hipertensió i la deficiència de potassi (hipocalèmia) combinada amb una inadequada ingesta de tiamina ha produït morts en ratolins experimentals.[14]
Les sals de potassi, en posseir sabor salat, poden substituir fàcilment les de sodi en aquelles dietes on s'hagi de restringir aquest últim element.
Els suplements de potassi en medicina són usats en la majoria en conjunt amb diurètics de nansa i tiacides, una classe de diürètics que disminueixen els nivells de sodi i aigua corporal quan això és necessari, però al seu torn causen també pèrdua de potassi a l'orina. Individus nefròpates o que pateixin una malaltia renal poden patir efectes adversos sobre la salut en consumir grans quantitats de potassi. A la insuficiència renal crònica, els pacients que es troben sota tractament rebent diàlisi renal han de seguir una dieta estricta en el contingut de potassi aportat, atès que els ronyons controlen l'excreció de potassi i l'acumulació de potassi per falla renal pot causar problemes greus com una arrítmia cardíaca fatal. L'hipercalèmia aguda (excés de potassi) pot ser reduïda a través de tractament amb soda via oral,[15] glucosa,[16][17] hiperventilació[18] i perspiració.[19]
També és un element essencial per al creixement de les plantes. És un dels tres que consumeixen en major quantitat, ja que l'ió potassi intervé en la fotosíntesi, part important de la fisiologia dels vegetals.
Història
modificaEl potassi, el nom en català del qual ve del neollatí científic potassium, i aquest del neerlandès pottasche, cendra de pot —nom amb què el va batejar Humphry Davy en descobrir-lo el 1807— va ser el primer element metàl·lic aïllat per electròlisi, de l'hidròxid de potassi (KOH), compost del nom llatí del qual, Kalium, prové el símbol químic del potassi K.
El mateix Davy feia el següent relat del seu descobriment davant de la Royal Society of London el 19 de novembre de 1807: «Vaig col·locar un petit fragment de potassa sobre un disc aïllat de platí que comunicava amb el costat negatiu d'una bateria elèctrica de 250 plaques de coure i zinc en plena activitat. Un fil de platí que comunicava amb el costat positiu fou posat en contacte amb la cara superior de la potassa. Tot l'aparell funcionava a l'aire lliure. En aquestes circumstàncies es va manifestar una activitat molt viva; la potassa va començar a fondre's en els seus dos punts d'electrització. Va haver-hi en la cara superior (positiva) una viva efervescència, determinada pel despreniment d'un fluid elàstic; en la cara inferior (negativa) no es desprenia cap fluid elàstic, però van aparèixer petits glòbuls de viva brillantor metàl·lica completament semblants als glòbuls de mercuri. Alguns d'aquests glòbuls, a mesura que es formaven, cremaven amb explosió i flama brillant; altres perdien a poc a poc la seua brillantor i es cobrien finalment d'una crosta blanca. Aquests glòbuls formaven la substància que jo buscava; era un principi combustible particular, era la base de la potassa: el potassi».
La importància del descobriment rau en el fet que va confirmar la hipòtesi d'Antoine L. Lavoisier: si l'hidròxid de sodi (NaOH) i l'hidròxid de potassi (KOH) reaccionaven amb els àcids de la mateixa manera que els òxids de plom i argent era perquè estaven formats de la combinació d'un metall amb l'oxigen; extrem que es va confirmar en aïllar el potassi i tan sols una setmana després el sodi per electròlisi de la sosa. A més, l'obtenció del potassi va permetre el descobriment d'altres elements, ja que donada la seva gran reactivitat és capaç de descompondre òxids en robar-los l'oxigen; d'aquesta manera van poder aïllar-se el silici, el bor i l'alumini.
Abundància i obtenció
modificaEl potassi constitueix de l'orde del 2,4% en pes de l'escorça terrestre, cosa que en fa el setè element més abundant. Donada la seva insolubilitat és molt difícil obtenir el metall pur a partir dels seus minerals. Tot i això, en antics llits marins i de llacs existeixen grans dipòsits de minerals de potassi (carnal·lita, langbeinita, polihalita i silvita) en els que l'extracció del metall i les seves sals és econòmicament viable.
La principal mena de potassi és la potassa que s'extrau a Califòrnia, Alemanya, Nou Mèxic, Utah i altres llocs. A Saskatchewan hi ha grans dipòsits de potassa a 900 m de profunditat, que en el futur poden convertir-se en fonts importants de potassi i sals de potassi.
Els oceans també poden ser proveïdors de potassi, però en un volum qualsevol d'aigua salada la quantitat de potassi present és molt menor que la de sodi, quedant minvat el rendiment econòmic de l'operació.
Gay-Lussac i Louis J. Thénard van utilitzar el 1808 un mètode consistent a fondre la potassa i fer-la travessar ferro escalfat al blanc per a obtenir el potassi, mètode que es va emprar fins a 1823, any en què Brunner va obtenir el metall escalfant a alta temperatura una mescla de carbonat potàssic i carbó. Ambdós mètodes tenien un rendiment molt deficient, fins que Sainte-Claire Deville va descobrir que el mètode de Brunner podia ser millorat utilitzant carbonat de calci en la mescla. A l'actualitat el metall s'obté per electròlisi del seu hidròxid en un procés que ha patit tan sols petites modificacions des de l'època de Davy.
Isòtops
modificaEs coneixen disset isòtops de potassi, tres d'ells naturals K-39 (93,3%), K-40 (0,01%) i K-41 (6,7%); el K-40, amb un període de semidesintegració d'1,25E9 anys, decau a Ar-40 (11,2%) i Ca-40 (88,8%).
La desintegració del K-40 en Ar-40 s'empra com a mètode per a la datació de roques. El mètode K-Ar convencional es basa en la hipòtesi que les roques no contenien argó quan es van formar i que el format no va escapar d'elles, sinó que va ser retingut de manera que el present prové completament i exclusivament de la desintegració del potassi original. El mesurament de la quantitat de potassi i Ar-40 i aplicació d'aquest procediment de datació és adequat per a determinar l'edat de minerals com el feldespat volcànic, moscovita, biotita i hornblenda i en general les mostres de roques volcàniques i intrusives que no han patit alteració.
Més enllà de la datació, els isòtops de potassi s'han utilitzat molt en estudis del clima, així com en estudis sobre el cicle dels nutrients per ser un macronutrient requerit per a la vida.
L'isòtop K-40 està present en el calci natural en quantitat suficient perquè els sacs de compostos de potassi comercial puguin emprar-se en les demostracions escolars com a font radioactiva.
Precaucions
modificaEl potassi sòlid reacciona violentament amb l'aigua, més fins i tot que el sodi, així que s'ha de conservar immers en un líquid apropiat com oli o querosè.
Referències
modifica- ↑ Augustyn, Adam. «Potassium/ Chemical element». A: Encyclopedia Britannica [Consulta: 27 novembre 2019]. Arxivat 2019-07-09 a Wayback Machine.
- ↑ Webb, D. A. «The Sodium and Potassium Content of Sea Water». The Journal of Experimental Biology, 2, abril 1939, pàg. 183. Arxivat de l'original el 2019-09-24 [Consulta: 27 novembre 2019].
- ↑ Greenwood, p. 73
- ↑ Mans i Teixidó, 2020, p. 29.
- ↑ «potassi». Gran Enciclopèdia Catalana. Grup Enciclopèdia Catalana. [Consulta: 7 març 2024].
- ↑ Mahan, K. Escott S. Nutrición y dietoterapia de Krause.1996
- ↑ Potts, W.T.W.. Osmotic and ionic regulation in animals. Pergamon Press, 1964.
- ↑ Bennett CM, Brenner BM, Berliner RW «Micropuncture study of nephron function in the rhesus monkey». J Clin Invest, 47, 1, 1968, pàg. 203-216. 16695942.
- ↑ Solomon AK «Pumps in the living cell». Sci. Am., 207, 1962, pàg. 100-8. 13914986.
- ↑ Wright FS «Sites and mechanisms of potassium transport along the renal tubule». Kidney Int., 11, 6, 1977, pàg. 415-32. 10.1038/ki.1977.60875263.
- ↑ Squires RD, Huth EJ «Experimental potassium depletion in normal human subjects. I. Relation of ionic intakes to the renal conservation of potassium». J. Clin. Invest., 38, 7, 1959, pàg. 1134-48. 10.1172/JCI10389013664789.
- ↑ http://www.pamf.org/patients/pdf/potassium_count.pdf Arxivat 2010-07-03 a Wayback Machine.
- ↑ «Alimentos ricos en potasio». Arxivat de l'original el 2017-11-16. [Consulta: 2009].
- ↑ Folis, R.H. «Myocardial Necrosis in Rats on a Potassium Low Diet Prevented by Thiamine Deficiency». Bull. Johns-Hopkins Hospital, 71, 1942, pàg. 235.
- ↑ Berliner RW, Kennedy TJ, Orloff J «Relationship between acidification of the urine and potassium metabolism; effect of carbonic anhydrase inhibition on potassium excretion». Am. J. Med., 11, 3, 1951, pàg. 274-82. 10.1016/0002-9343(51)90165-914877833.
- ↑ Knochel JP «Diuretic-induced hypokalemia». Am. J. Med., 77, 5A, 1984, pàg. 18-27. 10.1016/S0002-9343(84)80004-26496556.
- ↑ Kolb H, Burkart V «Nicotinamide in type 1 diabetes. Mechanism of action revisited». Diabetes Care, 22 Suppl 2, 1999, pàg. B16-20. 10097894.
- ↑ Kilburn KH «Movements of potassium during acute respiratory acidosis and recovery». J Appl Physiol, 21, 2, 1966, pàg. 679-84. 5934480.
- ↑ Consolazio CF, Matoush LO, Nelson RA, Harding RS, Canham JE «Excretion of sodium, potassium, magnesium and iron in human sweat and the relation of each to balance and requirements». J. Nutr., 79, 1963, pàg. 407-15. 14022653.
Bibliografia
modifica- Mans i Teixidó, C. «Per què hi ha tants metalls a la taula periòdica?». L'Atzavara, 30, 2020, pàg. 27-31. DOI: 10.2436/20.1502.atz30.027.
- Diccionario Enciclopédico hispanoamericano, Tom XVI, Barcelona, Montaner i Simón Editors, 1895.
- Greenwood, Norman N.; Earnshaw, Alan. Chemistry of the Elements. 2a edició. Butterworth-Heinemann, 1997. ISBN 978-0-08-037941-8.
Enllaços externs
modifica- Enciclopèdia Lliure (castellà).
- Los Alamos National Laboratory – Potassi Arxivat 2004-04-09 a Wayback Machine. (anglès).
- webelements.com – Potassi (anglès).
- environmentalchemistry.com – Potassi (anglès).