Gal·li
El gal·li és l'element químic de símbol Ga i nombre atòmic 31. Pertany al 4t període de la taula periòdica i al grup 13. La seva existència i propietats foren predites el 1869 pel químic rus Dmitri I. Mendeléiev sobre la base del seu descobriment de la llei periòdica. Fou el primer element en ésser descobert la qual existència havia sigut predita. El descobridor fou el francès Paul Émile Lecoq de Boisbaudran mitjançant espectroscòpia atòmica el 1875,[1] el qual l'anomenà gal·li en honor de França, que ocupa la major part de la regió que els antics romans coneixien com a Gàl·lia. És un metall tou, grisenc en estat líquid i argentat brillant al sodificar. Es pot arribar a fondre a temperatura ambient degut a que la seva temperatura de fusió és de només 28,76 °C
| Gal·li | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
31Ga
| |||||||||||||||||||
| |||||||||||||||||||
| Aspecte | |||||||||||||||||||
Blanc-platejat  Línies espectrals del gal·li | |||||||||||||||||||
| Propietats generals | |||||||||||||||||||
| Nom, símbol, nombre | Gal·li, Ga, 31 | ||||||||||||||||||
| Categoria d'elements | Metalls del bloc p | ||||||||||||||||||
| Grup, període, bloc | 13, 4, p | ||||||||||||||||||
| Pes atòmic estàndard | 69,723(1) | ||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 3d10 4p1 2, 8, 18, 3 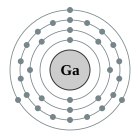
| ||||||||||||||||||
| Propietats físiques | |||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||
| Densitat (prop de la t. a.) |
5,91 g·cm−3 | ||||||||||||||||||
| Densitat del líquid en el p. f. |
6,095 g·cm−3 | ||||||||||||||||||
| Punt de fusió | 302,9146 K, 29,7646 °C | ||||||||||||||||||
| Punt d'ebullició | 2.477 K, 2.204 °C | ||||||||||||||||||
| Entalpia de fusió | 5,59 kJ·mol−1 | ||||||||||||||||||
| Entalpia de vaporització | 254 kJ·mol−1 | ||||||||||||||||||
| Capacitat calorífica molar | 25,86 J·mol−1·K−1 | ||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||
| |||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||
| Estats d'oxidació | 3, 2, 1 (òxid amfòter) | ||||||||||||||||||
| Electronegativitat | 1,81 (escala de Pauling) | ||||||||||||||||||
| Energies d'ionització (més) |
1a: 578,8 kJ·mol−1 | ||||||||||||||||||
| 2a: 1.979,3 kJ·mol−1 | |||||||||||||||||||
| 3a: 2.963 kJ·mol−1 | |||||||||||||||||||
| Radi atòmic | 135 pm | ||||||||||||||||||
| Radi covalent | 122±3 pm | ||||||||||||||||||
| Radi de Van der Waals | 187 pm | ||||||||||||||||||
| Miscel·lània | |||||||||||||||||||
| Estructura cristal·lina | Ortoròmbica 
| ||||||||||||||||||
| Ordenació magnètica | Diamagnètic | ||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 270 nΩ·m | ||||||||||||||||||
| Conductivitat tèrmica | 40,6 W·m−1·K−1 | ||||||||||||||||||
| Dilatació tèrmica | (25 °C) 18 µm·m−1·K−1 | ||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 2.740 m·s−1 | ||||||||||||||||||
| Mòdul d'elasticitat | 9,8 GPa | ||||||||||||||||||
| Coeficient de Poisson | 0,47 | ||||||||||||||||||
| Duresa de Mohs | 1,5 | ||||||||||||||||||
| Duresa de Brinell | 60 MPa | ||||||||||||||||||
| Nombre CAS | 7440-55-3 | ||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||
| Article principal: Isòtops del gal·li | |||||||||||||||||||
| |||||||||||||||||||
El gal·li s'utilitza principalment en electrònica. L'arsenur de gal·li, el compost químic primari del gal·li en electrònica, s'utilitza en circuits de microones, circuits de commutació d'alta velocitat i circuits infrarojos. El nitrur de gal·li semiconductor i el nitrur de gal·li produeixen díodes emissors de llum (LED) blaus i violetes i làsers de díodes. El gal·li també s'utilitza en la producció de granat de gal·li gadolini artificial per a joies. El gal·li és considerat un element tecnològic crític per la Biblioteca Nacional de Medicina dels Estats Units i l'editorial Frontiers.[2][3]
El gal·li no té un paper natural conegut en biologia. El gal·li (III) es comporta de manera similar a les sals fèrriques en sistemes biològics i s'ha utilitzat en algunes aplicacions mèdiques, com ara productes farmacèutics i radiofàrmacs.
Història modifica
Abans del seu descobriment la majoria de les seves propietats foren correctament predites i descrites el 1869 pel químic rus Dmitri I. Mendeléiev (1834-1907) —que l'anomenà eka-alumini, que significa sota l'alumini— basant-se en la posició que havia d'ocupar l'element en la taula periòdica que havia dissenyat Mendeléiev. Fou descobert per mitjà d'espectroscòpia atòmica pel químic francès Paul-Émile Lecoq de Boisbaudran (1838-1912) el 1875 pel seu característic espectre (dues línies ultraviolades) a l'examinar una blenda de zinc procedent de la mina Pierrefitte, ubicada a la vall d'Argilèrs al departament dels Alts Pirineus.[4] Aquest mateix any l'aïllà per electròlisi de l'hidròxid en una solució d'hidròxid de potassi i li donà el nom gal·li, del llatí Gallia, el nom amb el qual coneixien els antics romans al territori de l'actual França.[5][6] Algunes de les primeres dades experimentals de les seves propietats foren criticades per Mendeléiev, segur de la capacitat de predicció de la seva llei periòdica. La predicció era que la densitat havia de ser 5,9 g/cm³ i els resultats experimentals donaven un valor inferior, 4,3 g/cm³. Ràpidament Mendeléiev envià una carta a la mateixa revista indicant les propietats que hauria de tenir el gal·li.[7] Lecoq de Boisbaudran repetí la determinació de la densitat amb una mostra més pura i obtingué un nou valor de 5,9 g/cm³, la qual cosa confirmà la validesa de la llei periòdica.[5][8] Per altra banda alguns científics acusaren Lecoq de Boisbaudran d'haver posat gal·li pel seu nom. El seu llinatge Lecoq voldria dir le coq, el gall, i en llatí gall és gallus. Però Lecoq de Boisbaudran sempre negà aquesta relació.[9]
Abundància i obtenció modifica
Quant a abundància dels elements a l'escorça terrestre ocupa la posició 34, amb una concentració mitjana de 18 ppm. És present als sols i a la mar, però no a l'atmosfera.[6] Només s'han descrit onze minerals que contenen gal·li. Els que el contenen en major proporció, superior a l'1 % són: tsumgallita 59,93 %; söhngeïta 57,74 %; gal·lita 35,32 %; krieselita 15,10 %; i gal·lobeudantita 14,55 %.[10] Es troben traces del metall en minerals com la bauxita, carbó, germanita i esfalerita i és subproducte en els processos d'obtenció de diversos metalls.[11]
El principal productor mundial és la Xina amb 310 000 kg el 2019. De lluny li segueixen Rússia i Ucraïna amb 4 000 kg cadascun, i el Japó i Corea del Sud amb 3 000 kg cadascun. La majoria del gal·li es produeix com a subproducte del processament de bauxita i la resta es produeix a partir de residus de processament de zinc. La bauxita conté una mitjana de 50 ppm de gal·li. Es calcula que el gal·li contingut en els recursos mundials de bauxita supera el milió de tones i una quantitat semblant podrien contenir els recursos mundials de zinc. Tanmateix, menys del 10 % del gal·li present en la bauxita i en el zinc és potencialment recuperable.[12]
Propietats modifica
Propietats físiques modifica
El gal·li és un metall tou, grisenc en estat líquid i argentat brillant en sodificar, sòlid a baixes temperatures. En el punt de fusió la densitat del líquid és de 6,095 g/cm³ i la del sòlid 5,904 g/cm³. S'expandeix un 3,1 % al solidificar i el gal·li sòlid sura en el gal·li líquid, igual que el gel en l'aigua. Es pot arribar a fondre a temperatura ambient (com el cesi, el mercuri i el rubidi) i inclús es fon quan se l'agafa amb la mà pel seu baix punt de fusió (28,76 °C). El rang de temperatura en què roman líquid és un dels més alts dels metalls (2 174 °C separen els seus punt de fusió i punt d'ebullició, que és de 2 204 °C) i la pressió de vapor és baixa inclús a altes temperatures. Presenta una pronunciada tendència a subrefredar-se per sota del punt de fusió (romanent encara en estat líquid), i per això és necessari un nucli (una petita quantitat del sòlid afegit al líquid) per a solidificar el líquid.[11]
La cristal·lització no es produeix en cap de les estructures simples; la fase estable en condicions normals és ortoròmbica, amb 8 àtoms en cada cel·la unitària en què cada àtom només en té un altre en el seu veïnat més pròxima a una distància de 2,44 Å i estant els altres sis a 2,83 Å. En aquesta estructura l'enllaç químic format entre els àtoms més pròxims és covalent sent la molècula Ga₂ la que realment forma l'entramat cristal·lí.
A altres pressions i temperatura s'han trobat nombroses fases estables i metaestables distintes.
Propietats químiques modifica
L'estat d'oxidació més habitual del gal·li és el +3, però també presenta el +2 en alguns composts i molt rarament el +1. El gal·li provoca la corrosió d'altres metalls al difondre's en les seves xarxes cristal·lines. Amb l'hidrogen forma l'hidrur de gal·li . Hi ha tres òxids de gal·li on el gal·li intervé amb números d'oxidació +1, +2 i +3. Les fórmules respectives són , i . Amb els halògens forma el trifluorur de gal·li , que pot presentar-se trihidratat , el tetraclorur de digal·li , l'hexaclorur de digal·li , el tribromur de gal·li i l'hexaiodur de digal·li . Amb el sofre forma el sulfur de gal·li i el trisulfur de digal·li . Amb el seleni el selenur de gal·li i el triselenur de digal·li . Amb el tel·lur el tel·lurur de gal·li i el tritel·lurur de digal·li . Amb el nitrogen, fòsfor, arsènic i antimoni forma el nitrur de gal·li ,[13] el fosfur de gal·li l'arsenur de gal·li i l'antimonur de gal·li .[11]
De composts ternaris destaquen els compostos de gal·li(3+): l'hidròxid de gal·li , el nitrat de gal·li, el clorat de gal·li—aigua(1/6) , el sulfat de gal·li i el sulfat de gal·li—aigua(1/18) .[11]
Isòtops modifica
Hi ha dos isòtops naturals, el gal·li 69, que constitueix el 60,11 % del gal·li natural, i el gal·li 71 que representa el 30,89 % restant. A més d'aquests dos s'han descrit vint-i-sis isòtops i isòmers, que van del gal·li 56 al gal·li 87, essent el gal·li 67 el que té un temps de desintegració més llarg, 3,26 dies, seguit del gal·li 72 amb 14,10 hores. Deu d'ells, del gal·li 75 al gal·li 84, són productes de la fissió nuclear de l'urani 235.[14]
Aplicacions modifica
Generació d'energia modifica
El selenur de coure, gal·li i indi o CIGS, fe fórmula , és un semiconductor que s'utilitza en la fabricació de la capa fina conductora de les cel·les solars primes; és una alternativa eficaç al silici cristal·lí. L'aliatge de gal·li amb alumini proporciona una font d'hidrogen mitjançant una reacció amb l'aigua. Aquest mètode es pot utilitzar per a fer funcionar motors i piles de combustible amb hidrogen.[15]
Indústria electrònica modifica
L'arsenur de gal·li i el nitrur de gal·li s'utilitzen com a semiconductors en la fabricació de díodes emissors de llum (LED) de llum blava, en els flaixos de les càmeres fotogràfiques, els llums de les bicicletes i en la il·luminació interior d'autobusos, trens i avions.[15] L'obtenció del LED blau fou un avanç molt important perquè amb els LEDs vermell i verd es pot aconseguir llum blanca. Per aquesta raó els descobridors Isamu Akasaki, Hiroshi Amano i Shuji Nakamura foren guardonats amb el Premi Nobel de Física del 2014.[16] L'arsenur de gal·li s'usa també en la fabricació de circuits integrats.
Medicina modifica
L'aliatge de gal·li, indi i estany (galinstan) s'usa en substitució del mercuri en termòmetres clínics. El nitrat de gal·li és usat com a medicament intravenós per a tractar la hipercalcèmia, malaltia associada al càncer d'ossos. Els radioisòtops gal·li 67 i gal·li 68 es fan servir per a valorar processos inflamatoris en general, però sobretot en els pulmons i els ossos. Tot i que, el gal·li 67 ha estat desplaçat pel fluor 18.[15]
En medicina nuclear s'empra el gal·li com a element traçador (escànner de gal·li) per al diagnòstic de malalties inflamatòries o infeccioses actives, tumors i abscessos, ja que s'acumula en els teixits que pateixen aquestes patologies. L'isòtop gal·li 67 s'injecta en el torrent sanguini a través d'una vena del braç en forma de citrat de gal·li realitzant-se l'escànner dos o tres dies després per a donar temps a què aquest s'acumuli en els teixits afectats. Posteriorment s'elimina principalment en l'orina i els excrements. L'exposició a la radiació és inferior a la causada per altres procediments com els rajos X.
Els investigadors han descobert la biocompatibilitat del nitrur de gal·li. Aquest descobriment podria conduir a elèctrodes més segurs i eficients que estimulin les neurones en el cervell per a tractar trastorns neurològics com la malaltia d'Alzheimer. Els composts de gal·li(3+) tenen un important efecte bactericida en competir amb el ferro(3+) en les cadenes metabòliques oxidatives dels bacteris.[9]
Referències modifica
- ↑ Scerri, Eric. The Periodic Table: Its Story and Its Significance. Oxford University Press, 2020, p. 149. ISBN 978-0-19-091436-3.
- ↑ Cobelo-García, A.; Filella, M.; Croot, P.; Frazzoli, C.; Du Laing, G.; Ospina-Alvarez, N.; Rauch, S.; Salaun, P.; Schäfer, J. «COST action TD1407: network on technology-critical elements (NOTICE)—from environmental processes to human health threats». Environmental Science and Pollution Research International, 22, 19, 2015, pàg. 15188–15194. DOI: 10.1007/s11356-015-5221-0. ISSN: 0944-1344. PMC: 4592495. PMID: 26286804.
- ↑ Romero-Freire, Ana; Santos-Echeandía, Juan; Neira, Patricia; Cobelo-García, Antonio «Less-Studied Technology-Critical Elements (Nb, Ta, Ga, In, Ge, Te) in the Marine Environment: Review on Their Concentrations in Water and Organisms» (en anglès). Frontiers in Marine Science, 6, 2019. DOI: 10.3389/fmars.2019.00532. ISSN: 2296-7745.
- ↑ Lecoq de Boisbaudran, P.E. «Caractères chimiques et spectroscopiques d'un nouveau métal, la Gallium, découvert dans une blende de la mine Pierrefitte, vallée d'Argelès (Pyrénées)». Comptes Rendus, 1875, pàg. 493-495.
- ↑ 5,0 5,1 Lecoq de Boisbaudran, P.E. «Sur un nouveau métal, le gallium». Annales de chimie et de physique, 5ème série, X, 1877, pàg. 100-141.
- ↑ 6,0 6,1 Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ Mendeléiev, D.I. «Remarques à propos de la découverte du gallium». Comptes rendus, 1875, pàg. 969-972.
- ↑ Bortz, F. The periodic table of elements and Dmitry Mendeleyev (en anglès). Nova York: The Rosen Publishing Group, Inc., 2013. ISBN 9781477718162.
- ↑ 9,0 9,1 Belsué Cuartero, J.R. «Z = 31, galio, Ga. Un metal un tanto chovinista». An. Quím., 115, 2, 2019, pàg. 93. Arxivat de l'original el 2020-02-07 [Consulta: 2 juliol 2020].
- ↑ «Mineral Species sorted by the element Ga Gallium». [Consulta: 3 juliol 2020].
- ↑ 11,0 11,1 11,2 11,3 William M. Haynes. CRC handbook of chemistry and physics (en anglès). 93rd edition. Boca Raton, FL: CRC Press, 2016. ISBN 978-1-4398-8050-0.
- ↑ «Gallium Statistics and Information» (en anglès). United States Geological Survey, Gener 2020. [Consulta: 3 juliol 2020].
- ↑ «WebElements Periodic Table » Gallium » compounds information». [Consulta: 5 juliol 2020].
- ↑ «Nudat 2» (en anglès). National Nuclear Data Center, Brookhaven National Laboratory. [Consulta: 3 juliol 2020].
- ↑ 15,0 15,1 15,2 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. Universitat Politècnica de Catalunya, 2017. ISBN 978-84-9880-666-3.
- ↑ Van Noorden, R. «Blue LED discovery wins Physics Nobel : News blog» (en anglès). Nature, 07-10-2014. Arxivat de l'original el 2020-07-04. [Consulta: 3 juliol 2020].
Enllaços externs modifica
- Enciclopèdia Llibre (castellà)
- Los Alamos National Laboratory - Gal·li Arxivat 2006-02-06 a Wayback Machine. (anglès)
- webelements.com - Gal·li (anglès)
- environmentalchemistry.com - Gal·li (anglès)