Berkeli
El berkeli és un element sintètic de la taula periòdica el símbol del qual és el Bk i el seu nombre atòmic és 97. Pertany a la sèrie dels actinoides i fou el cinquè element transurànic en sintetitzar-se. S.G. Thomson, A. Ghiorso i G.T. Seaborg l'obtingueren el 1949 bombardejant americi 241, descobert només cinc anys abans pel mateix equip d'investigadors, amb partícules α. El nom és en honor a la ciutat californiana de Berkeley, on se sintetitzà. Posteriorment, fou identificat a la natura al reactor nuclear natural d'Oklo, Gabon, en quantitats molt petites. L'isòtop més estable és el berkeli 247 (t½ = 1.380 a), però és difícil obtenir-lo. L'isòtop berkeli 249 s'empra per produir californi 250 i fou emprat per sintetitzar per primer cop l'element tennes bombardejant-lo amb cations calci 48 el 2009.
| Berkeli | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
97Bk
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||
Platejat Berkeli metàl·lic  Línies espectrals del berkeli | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Berkeli, Bk, 97 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Actínids | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | (247) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 5f9 7s2 2, 8, 18, 32, 27, 8, 2 
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(alfa) 14,78 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(beta) 13,25 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | (beta) 1.259 K, 986 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | (beta) 2.900 K, 2.627 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,3 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energia d'ionització | 1a: 601 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 170 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal empaquetada compacta 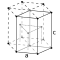
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 10 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-40-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del berkeli | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Història modifica
El berkeli fou obtingut per primera vegada pels químics estatunidencs Stanley G. Thomson (1912-1976) i Glen T. Seaborg (1912-1999) i l'enginyer Albert Ghiorso (1915-2010) el desembre de 1949 al Laboratori nacional Lawrence Berkeley, aleshores Radiation Laboratory, de la Universitat de Califòrnia a Berkeley. La síntesi d'aquest nou element químic artificial l'obtingueren irradiant 7 mg de l'isòtop americi 241 amb partícules α al ciclotró de 60 polzades de la universitat durant un parell d'hores. L'isòtop generat, el berkeli 243, té una vida mitjana de 4,4 h desintegrant-se majoritàriament per captura electrònica en un 99,85 % donant curi 243 i per emissió alfa en només un 0,15 % donant plutoni 237.[1]
Fou aïllat de la resta d'elements químics mitjançant una combinació dels mètodes de precipitació i de bescanvi iònic a partir de la predicció dels seus estats d'oxidació (+3 i +4) sobre la base de la seva posició en la sèrie dels actinoides de la taula periòdica. Proposaren el nom berkeli per la ciutat de Berkeley, Califòrnia, on havia sigut obtingut.[2]
El descobriment del berkeli cridà l'atenció de la revista The New Yorker que el veié com a part d'un nombre creixent de nous elements i suggerí de broma que la Universitat de Califòrnia a Berkeley havia perdut una oportunitat d'or d'immortalitzar-se per sempre a la taula periòdica. L'article deia que haurien d'haver anomenat la seqüència de nous elements transurànics universitium, oftuny, californium i berkelium (de University of California, Berkeley). Glenn Seaborg respongué a l'article dient que havien pensat en això, però que obriria la porta perquè algú de Nova York descobrís els dos elements següents i els anomenaria newium i yorkium. El New Yorker replicà que ja estaven treballant molt en els nous elements, però fins ara només tenien els seus noms.[3]
Estat natural i obtenció modifica
El berkeli es troba de manera natural a la Terra, però només en quantitats insignificants: és el menys abundant de tots els elements naturals. Hi ha només dos isòtops de berkeli, berkeli 249 i berkeli 250. Aquests isòtops es produïren durant centenars de milers d'anys en reactors nuclears naturals que començaren a funcionar fa uns 1.800 milions d'anys, seguint processos geològics naturals que concentraven l'urani. Això donà lloc al fet que setze reactors nuclears naturals entrassin en funcionament a Oklo, Gabon, a l'Àfrica. En aquests reactors operaven de manera contínua i, mitjançant processos de captura de neutrons i desintegracions β, i produïren els elements transurànics dels nombres atòmics 83 (neptuni) al 100 (fermi), inclòs el berkeli.[3]
Les reaccions de captura de neutrons seguides de desintegració β que condueixen al berkeli impliquen isòtops d'americi i curi, i són:[4]
El curi 249 es produeix per captura de neutrons del curi 244 i per emissió β dona berkeli 249, i aquest pot capturar un neutró i produeix berkeli 250. Aquests isòtops tenen vides mitjanes força curtes i es desintegren ràpidament.[3][4]
A l'espai també s'ha identificat per espectroscòpia el berkeli a l'estrella de Przybylski (V816 Centauri). És un estel situat a la constel·lació de Centaure, de magnitud aparent +8,02, descoberta per l'astrònom polonès Antoni Przybylski (1913-1985) el 1961. És un estel químicament peculiar extrem, amb línies espectrals fortes d'elements lantanoides i transurànics.[5]
La síntesi del berkeli 247, el que té una semivida més llarga (t½ = 1 380 a) és molt ineficient i no se'n sintetitza. El berkeli 249 (t½ = 330 d) es pot obtenir bombardejant amb un flux de neutrons curi 244. Cal que aquest radionúclid absorbeixi cinc neutrons per transformar-se en curi 249, que té un període de semidesintegració de només 64 minuts, el qual a través d'una emissió β dona el berkeli 249. Les reaccions són les mateixes que es produeixen als reactors nuclears naturals.[4]
Propietats modifica
Propietats físiques modifica
El berkeli té una densitat de 14,8 g/cm³[6] i un punt d'ebullició de 996 °C, és electropositiu, reactiu i de lluïssor argentada com els altres metalls actinoides. La seva configuració electrònica és [Rn] 5f⁹7s2.[7]
Propietats químiques modifica
Les investigacions químiques han demostrat que el berkeli existeix en dissolucions aquoses amb estats d'oxidació +3 i +4, presumiblement com a ions i . Les propietats de solubilitat del berkeli en els seus dos estats d'oxidació són similars a les dels altres actinoides i als elements lantanoides (sobretot ceri) als estats d'oxidació corresponents. L'estat d'oxidació +3 és el que dona lloc a més composts, en són exemples l'òxid de berkeli(III) , el fluorur de berkeli(III) , el clorur de berkeli(III) ,[6] el sulfur de berkeli(III) , el nitrur de berkeli(III) , el nitrat de berkeli(III)—aigua(1/4) i el sulfat de berkeli(III)—aigua(1/12), . En l'estat d'oxidació +4 hi ha menys composts, els més destacats són l'òxid de berkeli(IV) , el fluorur de berkeli(IV) , el clorur de berkeli(IV) i cesi i .[8]
L'òxid de berkeli(IV) es pot sintetitzar per calcinació amb aire a 1 200 °C. Si es redueix aquest òxid a 600 °C amb un corrent d'hidrogen s'obté l'òxid de berkeli(III) , segons les reaccions:[9]
Isòtops modifica
Actualment, es coneixen o s'han sintetitzat tretze isòtops del berkeli que van des del nombre màssic 234 al 254.[7] Tots els isòtops del berkeli són radioactius; el berkeli 247 és el que més temps dura (1.379 anys de període de semidesintegració) i es desintegra en un 100 % mitjançant emissió d'una partícula α donant americi 243:[1]
El berkeli 249 (període de semidesintegració de 330 dies) ha estat àmpliament utilitzat en els estudis químics de l'element perquè es pot produir en quantitats pesables isotòpicament pures per a reaccions nuclears que comencen amb el curi 244.[6] També es desintegra per emissió d'una partícula α en un 100 % i produeix americi 245:[1]
Aplicacions modifica
El berkeli no té en l'actualitat aplicacions comercials. Tanmateix, es prepara berkeli 249 amb finalitats científiques, especialment per a la síntesi d'altres actinoides i d'elements superpesants.[7] Així el californi 250 es produeix bombardejant berkeli 249 amb neutrons, la qual cosa forma berkeli 250 mitjançant captura neutrònica que, al seu torn, pateix una ràpida desintegració β per esdevenir californi 250 seguint la següent reacció:[10]
Dos isòtops diferents del tennes, el tennes 293 i el tennes 294, foren produïts emprant reaccions nuclears molt asimètriques, fent incidir en un ciclotró un feix extremadament intens d'ions calci 48 sobre un blanc de berkeli 249. Aquest havia sigut sintetitzat per irradiació durant més de vuit mesos de curi i americi en el reactor d'alt flux del Laboratori Nacional d'Oak Ridge (ORNL), a l'estat de Tennessee, EUA. Després de la separació química, duta a terme també en l'ORNL, s'obtingueren 22,2 mg de berkeli 249 amb una quantitat mínima d'impureses. La reacció nuclear de fusió calenta produí un nucli atòmic compost de nombre atòmic Z = 117 i 180 neutrons, el tennes 297, que seguidament perdé 4 o 3 neutrons per a donar tennes 293 i tennes 294, respectivament. Les reaccions nuclears són:[11]
Toxicitat modifica
Com la resta d'actinoides, el berkeli tendeix a acumular-se en el sistema esquelètic. La màxima quantitat admissible per a l'isòtop berkeli 249 en l'esquelet humà és de 0,0004 μg.[7]
Referències modifica
- ↑ 1,0 1,1 1,2 «Z = 97». NuDat 3.0. National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 23 febrer 2023].
- ↑ Thompson, S. G.; Ghiorso, A.; Seaborg, G. T. «Element 97» (en anglès). Physical Review, 77, 6, 15-03-1950, pàg. 838-839. DOI: 10.1103/PhysRev.77.838.2. ISSN: 0031-899X.
- ↑ 3,0 3,1 3,2 Emsley, John. Nature's Building Blocks : an a-Z Guide to the Elements.. 2a edició. Oxford: Oxford University Press, Incorporated, 2011. ISBN 978-0-19-257046-8.
- ↑ 4,0 4,1 4,2 Evans, John. Elements of a sustainable world. Oxford, United Kingdom: Oxford University Press, 2020. ISBN 978-0-19-256288-3.
- ↑ Gopka, V. F.; Yushchenko, A. V.; Yushchenko, V. A.; Panov, I. V.; Kim, Ch. «Identification of absorption lines of short half-life actinides in the spectrum of Przybylski’s star (HD 101065)» (en anglès). Kinematics and Physics of Celestial Bodies, 24, 2, 2008-04, pàg. 89-98. DOI: 10.3103/S0884591308020049. ISSN: 0884-5913.
- ↑ 6,0 6,1 6,2 «Berkelium | chemical element» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 12-04-2019. [Consulta: 26 març 2020].
- ↑ 7,0 7,1 7,2 7,3 William M. Haynes. CRC handbook of chemistry and physics (en anglès). 93rd edition. Boca Raton, FL: CRC Press, 2016. ISBN 978-1-4398-8050-0.
- ↑ L.R. Morss, Norman M. Edelstein, Jean Fuger. The chemistry of the actinide and transactinide elements.. 3rd ed.. Dordrecht: Springer Science & Business Media, 2006. ISBN 978-1-4020-3598-2.
- ↑ Allen M. Alper. High temperature oxides. Part II, Oxides of rare earths, titanium, zirconium, hafnium, niobium and tantalum. Nova York: Elsevier, 1970. ISBN 978-1-4832-7139-2.
- ↑ Heiserman, David L. Exploring chemical elements and their compounds. 1st ed. Blue Ridge Summit, PA: Tab Books, 1992. ISBN 0-8306-3018-X.
- ↑ Fraile, L.M. «Z = 117, teneso, Ts. En ruta hacia la isla de estabilidad de los elementos superpersados». An. Quím., 115, 2, 2019, pàg. 179. Arxivat de l'original el 2020-02-07 [Consulta: 23 febrer 2023].
- ↑ Rayner-Canham, Geoffrey. The periodic table: past, present, and future. Singapore: World Scientific, 2020. ISBN 978-981-12-1848-4.
Bibliografia complementària modifica
- Greenwood, Norman N.; Earnshaw, Alan. Chemistry of the Elements. 2nd. Butterworth-Heinemann, 1997. ISBN 978-0-08-037941-8.
- Holleman, Arnold F.; Wiberg, Nils. Textbook of Inorganic Chemistry. 102nd. de Gruyter, 2007. ISBN 978-3-11-017770-1.
- Peterson, J. R.; Hobart, D. E.. «The Chemistry of Berkelium». A: Advances in inorganic chemistry and radiochemistry. 28. Academic Press, 1984, p. 29–64. DOI 10.1016/S0898-8838(08)60204-4. ISBN 978-0-12-023628-2.
Enllaços externs modifica
- Los Alamos National Laboratory - Berkeli Arxivat 2006-09-29 a Wayback Machine. (anglès)
- És Elemental - Berkeli (anglès)
- webelements.com - Berkeli (anglès)
- environmentalchemistry.com - Berkeli (anglès)