Tumor de l'estroma gastrointestinal
El tumor de l'estroma gastrointestinal (GIST de l'anglès gastrointestinal stromal tumors), és un dels tumors mesenquimàtics més freqüents del tracte gastrointestinal (1-3 % de totes els càncers malignes gastrointestinals). Aquests són típicament definits com a tumors el comportament dels quals està induït per mutacions en el gen Kit del PDGFRA, i pot o no tenyir-se positivament pel Kit.[1]

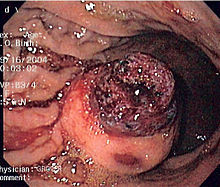
Signes i símptomes
modificaEls pacients presenten disfàgia, hemorràgia gastrointestinal o metàstasi (principalment en el fetge). L'obstrucció intestinal és rara, a causa del seu patró extraluminal de creixement. Sovint hi ha una història de dolor abdominal vague o malestar i el tumor es fa molt més gran pel temps que pren fer el diagnòstic.
Generalment el diagnòstic definitiu és fet amb una biòpsia, la qual pot ser obtinguda per via endoscòpica, per via percutània dirigida per TAC o ultrasò o en el moment del procediment quirúrgic.
Diagnòstic
modificaCom a part de les anàlisis també es realitzen, mostres de sang i TAC.
Un espècimen per a biòpsia podria ser analitzat sota el microscopi. L' anatomia patològica identifica les característiques dels GISTs (cèl·lules fusiformes en el 70-80 %, d'aspecte epiteloide en el 20-30 %). Tumors més petits poden ser usualment trobats en la capa muscular pròpia de la paret intestinal. Aquells amb major creixement, lluny de la paret de l'intestí, arriben al punt d'excedir l'aportació de sang i necrosar-se al centre, formant una cavitat que pot eventualment comunicar-se amb el lumen de l'intestí.
Quan existeix sospita de GIST els patòlegs poden fer servir immunohistoquímica (anticossos específics que marquen la molècula CD117 (també coneguda com a c-kit)). El 95 % de tots els GISTs són CD117 positius (altres possibles marcadors inclouen CD34, desmina, vimentina i uns altres). Altres cèl·lules que mostren positivitat per a CD117 són els mastòcits.
Si el marcador CD117 és negatiu i encara existeixen sospites que el tumor és a GIST, es pot fer servir el nou anticòs DOG-1 (Descobert a GIST-1). També la seqüenciació d'ADN de Kit i PDGFRA pot ser utilitzat per provar el diagnòstic.
Radiologia
modificaEls exàmens fluoroscòpics amb bari, de les vies digestives altes i les vies digestives baixes (trànsit intestinal) i el TAC són els més sovint usats per al diagnòstic de pacients amb dolor abdominal superior. Tots dos són adequats per fer el diagnòstic de GIST, no obstant això els tumors petits poden romandre ocults, especialment en casos d'examens poc exhaustius.
Els GISTs petits apareixen com a masses intramurals. Quan creixen (> 5 cm), la majoria d'ells ho fan amb major freqüència cap a fora de l'intestí. Poden existir calcificacions. Quan disminueix l'aportació sanguínia per al tumor, pot fer necrosi interna, creant una cavitat central plena de fluid que eventualment pot ulcerar-se en el lumen de l'intestí o l'estómac.
El tumor pot envair directament estructures en l'abdomen. El lloc més comú d'extensió és el fetge. També es pot donar una extensió al peritoneu. A diferència del càncer d'estómac o el limfoma gàstric o d'intestí prim, les adenopaties malignes (inflamació de nòduls limfàtics) són poc comuns (<10 %).
Patofisiologia
modificaEls GISTs són tumors del teixit conjuntiu, ex. sarcomes; a diferència de la majoria dels càncers intestinals, no són de tipus epiteli. El 70 % té lloc a l'estómac, 20 % a l'intestí prim i menys del 10 % a l'esòfag. Els tumors petits són en general, benignes, especialment quan la taxa de mitosi és baixa, però els tumors grans es disseminen al fetge, epipló i peritoneu. Rarament envaeixen altres òrgans abdominals.
Alguns tumors de l'estómac i intestí prim anomenats leiomiosarcomes (tumors malignes del múscul llis) podrien es reclasificats més sovint com a GISTs, basats en els marcadors inmunohistoquímics.
Els GISTs són originats a partir de les cèl·lules intersticials de Cajal, les quals normalment formen part del sistema nerviós autònom de l'intestí, funcionant com a missatgeres per al control de la motilitat intestinal.[2]
La major part dels GISTs, entre el (50-80 %), s'originen en una mutació en el gen anomenat c-kit. Aquest gen codifica un receptor trasmembrana d'un factor de creixement anomenat scf (factor de cèl·lules mare). El receptor c-kit/CD117 és expressat per les cèl·lules intesticials de Cajal i una gran quantitat d'altres cèl·lules, principalment de la medul·la òssia, mastòcits, melanòcits i algunes altres. En l'intestí, no obstant això, una massa que marqui positiva per a CD117 probablement és un GIST, originat de les cèl·lules intersticials de Cajal.
La molècula c-kit comprèn un gran domini extracel·lular, un segment trasmembrana, i una porció intracel·lular. Les mutacions generalment tenen lloc a l'ADN codificat en la part intracel·lular (exon 11), el qual actua com una Tirosina-cinasa per activar altres enzims. Les mutacions fan la funció de la c-kit independent de l'activació per scf, propiciat una alta taxa de divisió cel·lular i possiblement inestabilitat del genoma. És probable que mutacions addicionals siguin «requerides» per una cèl·lula amb una mutació c-kit per convertir-se en un GIST, però tal mutació de c-kit és probablement el primer pas dins del procés.
La funció de la tirosina cinasa de c-kit és vital per a la teràpia del GISTs.
Tractament
modificaLa grandària del tumor, la taxa de mitosi, i la localització poden ser utilitzats per predir el risc de recurrència en els pacients amb GISTs. Els tumors menors de 2 cm amb una taxa de mitosi de 5/50 HPF han mostrat tenir menor risc de recurrència que aquells més grans o més agressius. no obstant això, a tots els GISTs podria considerar-se'ls amb potencial de malignitat i els tumors no GIST poden ser correctament classificats com a «benignes».[3]
La cirurgia és la base del tractament el GISTs no metastàtic. Les metàstasis en nòduls limfàtics és rara i la remoció de rutina dels nòduls limfàtics usualment no és necessària. La resecció de marges amplis tampoc és necessària. La cirurgia laparoscòpica ha mostrat ser efectiva per la resecció d'aquests tumors sense requerir grans incisions.[4]
Fins fa poc temps, els GISTs eren notoris per ser resistents a la quimioteràpia, amb un percentatge d'èxit menor al 5 %. Recentment els c-kit inhibidors de tirosina quinasa com el imatinib (Glivec/Gleevec), un medicament inicialment comercialitzat per al tractament de la leucèmia mieloide crònica, va demostrar ser útil per al tractament dels GISTs, elevant a un 40-70 % el percentatge de resposta de metàstasi o casos inoperables.
Dades presentades el 2007 van mostrar que el tractament amb imatinib subsegüent a la resecció quirúrgica del GISTs, pot reduir significativament el risc de recurrència de la malaltia (6 % de recurrència amb Imatinib vs. 17 % sense tractament en 12 mesos). La durada òptima del tractament abjudant és actualment desconeguda; els estudis actuals estan avaluant la durada dels tractament per 1, 2, i 3 anys.
Els pacients que desenvolupen resistència al imatinib poden respondre a inhibidors múltiples de la tirosina cinasa com el sunitinib (comercialitzat com sutent).
L'efectivitat del imatinib i el sunitinib depèn del genotip.[5]
Epidemiologia
modificaEls GIST tenen lloc en aproximadament 10-20 casos per cada milió d'habitants. La veritable incidència podria ser més alta, en la mesura que els nous mètodes de laboratori siguin molt més sensibles per al diagnòstic del GISTs. Per tots hi ha 3500-5000 casos de GIST per any als Estats Units. Això fa al GIST el tipus més comú de sarcoma, els quals conformen un grup de més de 70 tipus de càncer, però en totes les seves formes constitueixen menys de l'1 % de tots els tumors.
Referències
modifica- ↑ Miettinen M, Lasota J «Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis». Arch. Pathol. Lab. Med., 130, 10, octubre 2006, pàg. 1466–78. PMID: 17090188.[Enllaç no actiu]
- ↑ Miettinen M, Lasota J «Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis». Arch Pathol Lab Med, 130, 10, 2006, pàg. 1466–78. PMID: 17090188.
- ↑ Raut, Chandrajit and Dematteo, Ronald «Evidence-Guided Surgical Management of GIST: Beyond a Simple Case of Benign and Malignant». Ann. Surg. Onc., 15, 5, marzo 2008, pàg. 1542. DOI: 10.1245/s10434-008-9817-1.
- ↑ Nguyen SQ, Divino CM, Wang JL, Dikman SH «Laparoscopic management of gastrointestinal stromal tumors». Surg Endosc, 20, 5, mayo 2006, pàg. 713–6. DOI: 10.1007/s00464-005-0435-8. PMID: 16502196.
- ↑ «News: Genetic Variations in GI Tumors Determine Which Medications Are Efficacious.». Genetic Engineering & Biotechnology News, 13-11-2008. Arxivat de l'original el 2009-03-02. [Consulta: 28 març 2020].