Dissolució diluïda ideal
Una dissolució diluïda ideal és una dissolució diluïda en què tots els soluts compleixen la llei de Henry i el dissolvent la llei de Raoult.[1]
- Llei de Henry: En una dissolució diluïda la pressió parcial d'un solut és directament proporcional a la seva fracció molar en la dissolució.
- on: És la pressió parcial del component ; és la constant de Henry; i és la seva fracció molar en la dissolució.
- Llei de Raoult: La pressió parcial d'un component d'una dissolució és igual a la pressió de vapor del mateix component pur per la fracció molar d'aquest component en la dissolució.
- on: És la pressió parcial del component ; és la seva pressió de vapor en estat pur; i és la seva fracció molar en la dissolució.
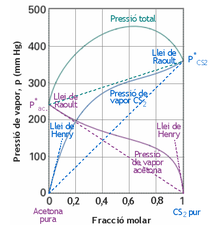
Són molt poques les dissolucions reals que segueixen la llei de Raoult, característica de les dissolucions ideals, per a totes les concentracions. El més habitual és que les corbes de pressió de vapor presentin desviacions positives de la llei de Raoult com la de la figura adjunta, corresponent al sistema acetona-disulfur de carboni, on s'observa que les corbes queden per damunt de les línies rectes que representen la llei de Raoult. I també es troben desviacions negatives, com ara en el sistema acetona-cloroform on les corbes queden per sota de les rectes de la llei de Raoult.
Nogensmenys si bé la majoria de mescles no segueixen la llei de Raoult, s'observa que quan les fraccions molars són properes a 1 (), les corbes són asimptòtiques a les línies rectes corresponents a la llei de Raoult. I també s'observa un altre fet important, i és que en la zona de baixes fraccions molars (), les corbes tendeixen asimptòticament a les rectes que s'obtenen amb la llei de Henry.[2]
Referències
modifica- ↑ Brillas, E. Conceptes de termodinámica química i cinètica. Barcelona: Edicions Universitat de Barcelona, 2004. ISBN 84-4752-841-1.
- ↑ Díaz Peña, M.; Roig Muntaner, A. Química física (en castellà). Madrid: Alhambra, 1980. ISBN 84-205-0575-7.








