Estoma
L'estoma és una estructura vegetal que regula l'intercanvi de gasos. Està format per un mínim de dues cèl·lules especialitzades de l'epidermis de les fulles dels organismes vegetals que s'anomenen cèl·lules oclusives i que deixen una obertura entre elles anomenada ostíol. L'ostíol és un porus que condueix a un ampli espai intracel·lular (la cambra subestomàtica) fent possible així la comunicació entre l'aire exterior i aquests espais entre cèl·lules. Aquests conjunts estan envoltats en molts casos per un altre tipus de cèl·lules anomenades annexes, acompanyants o subsidiàries que estan associades funcionalment als estomes, poden tenir diferents formes i són cèl·lules epidèrmiques poc especialitzades i que formen la majoria dels òrgans vegetals.
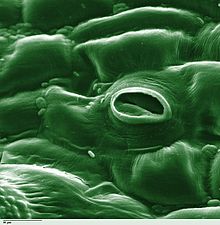
El diòxid de carboni de l'aire difon cap a l'interior de la fulla mitjançant l'obertura dels estomes i s'utilitza en la fotosíntesi. La planta transpira vapor d'aigua que surt també pels estomes. L'oxigen utilitzat a la respiració cel·lular i produït a la fotosíntesi, també pot travessar els estomes, però la seva gran quantitat a l'aire fa que també pugui travessar la cutícula de la fulla, per la qual cosa no s'associa normalment als estomes.
La forma, el nombre d'estomes i la seva disposició en les fulles és una característica de cada espècie i és molt variable. Generalment es troben a les parts aèries de les plantes superiors riques en clorofil·la (parts verdes) i també en alguns òrgans de les plantes inferiors com ara molses o plantes hepàtiques.
La majoria de les plantes obren els estomes durant el dia per permetre l'entrada de diòxid de carboni que serà utilitzat en la fotosíntesi ja que aquest procés obtè l'energia de la llum. Simultàniament a l'entrada de diòxid de carboni, es produeixen pèrdues d'aigua (transpiració) donat que l'aire de la cambra subestomàtica està saturat de vapor d'aigua mentre que l'aire atmosfèric habitualment no n'està. Les plantes del tipus "CAM" (sigles en anglès que corresponen a Crassulacean acid metabolysm o Metabolisme àcid de les plantes crasses) poden obrir els estomes durant la nit, quan la temperatura de l'aire és menor i la humitat relativa més alta i així minimitzen les pèrdues d'aigua. Això és possible perquè carboxilen amb ell altres molècules generant malat, que és emmagatzemat en el vacúol de la cèl·lula per a ser descarboxilat durant el dia en presència de llum, alliberant altre cop el diòxid de carboni que serà fixat en la fotosíntesis; el preu que paguen, en tenir la fotosíntesi limitada per la seva capacitat d'emmagatzemar malat en el vacúol durant la nit, és un creixement molt baix i lent; com a conseqüència, aquest metabolisme només és competitiu en les condicions molt àrides del desert i el semidesert. Tot i això, moltes plantes CAM ho són només facultativament, de manera que, en bones condicions hídirques, poden obrir els estomes durant el dia, o almenys durant les primeres hores quan encara les temperatures son baixes.
El mecanisme d'obertura i tancament estomàtic no és completament conegut però hi intervé la regulació de la pressió osmòtica amb l'ús de l'ió de potassi i també altres factors com ara els nivells de diòxid de carboni en el inerior de la fulla (cambra subestomàtica), la presència i intensitat de la llum, les condicions atmosfèriques com ara la temperatura, el pH del medi i sobretot l'estat hídric de la fulla (tot i que també reben senyals hormonals provinents de les arrels).
Morfologia
modificaDescripció morfològica.
modificaEn una vista frontal els estomes estan formats per dues cèl·lules estomàtiques (anomenades cèl·lules oclusives) amb forma de ronyó que es disposen paral·lelament i s'acoblen, formant així, entre cèl·lula i cèl·lula, un petit porus anomenat ostíol. L'ostíol comunica amb la cavitat subestomàtica que es troba sota l'estoma, i aquesta comunica amb la resta d'espais intercel·lulars adjacents.
Al voltant de les cèl·lules oclusives s'acostuma a trobar un parell o més de cèl·lules annexes (cèl·lules epidèrmiques modificades), són cèl·lules de suport que ajuden a les oclusives a realitzar les seves funcions.
Les cèl·lules oclusives tenen un gran nombre de cloroplasts, mitocondris, vacuoles, reticle endoplasmàtic i dictiosomes. Els cloroplasts contenen un nombre elevat de grànuls de midó que intervenen en el mecanisme d'obertura i tancament estomàtic. Hi ha connexió entre ambdues cèl·lules oclusives mitjançant plasmodesmes, aquests són útils a l'hora de sincronitzar el moviment estomàtic.[1]
Densitat estomàtica i índex estomàtic.
modificaLa densitat estomàtica està definida com el nombre d'estomes per unitat d'àrea. La densitat juntament amb la mida de les cèl·lules oclusives ve determinat tant per les condicions ambientals prevalents durant el creixement de la fulla com pel genoma de cada individu. Per exemple, degut a la pressió de la selecció natural, les plantes que viuen en els deserts, en general, estan programades per tenir una menor densitat estomàtica mentre que plantes que viuen en zones anegades no. Les condicions ambientals també poden determinar el nombre d'estomes: exposició intensa a la llum i baixes concentracions de CO₂ durant el desenvolupament condueixen a un increment en la densitat estomàtica de moltes espècies.[2] Degut a això, la densitat i l'ìndex estomàtic són paràmetres importants que ens poden indicar en quin tipus d'ambient viu la planta.
Índex estomàtic (%) = ; on S i E són el nombre d'estomes i el de cèl·lules epidèrmiques respectivament en un camp de microscopia òptica.[3]
Tipus d'estomes.
modificaActualment (2020) existeixen diverses classificacions sobre tipologies d'estomes basades en el seu desenvolupament, mida, en les cèl·lules annexes… Una de les més usades va ser creada per Julien Joseph Vesque al 1889 i posteriorment desenvolupada per Metcalfe i Chalk[4] i d'altres autors. Aquesta classificació es basa en la mida, disposició i forma de les cèl·lules annexes (o cèl·lules acompanyants).[5]
- Hipocític. Estoma format per un parell de cèl·lules oclusives disposades en una única filera, envoltades per cèl·lules epidèrmiques. Es troben dues cèl·lules annexes en la superfície externa de l'epidermis disposades de forma paral·lela respecte les cèl·lules oclusives i amb la presència d'un porus connectant ambdues.
- Pericític. Estoma format per un parell de cèl·lules oclusives envoltades completament per una única cèl·lula annexa (amb forma de “donut”).
- Desmocític. Estoma format per un parell de cèl·lules oclusives envoltades completament per una cèl·lula annexa que no ha acabat d'unir els seus extrems (forma de “salsitxa”).
- Polocític. Estoma format per un parell de cèl·lules oclusives envoltades en gran part per una única cèl·lula annexa. També hi ha contacte entre cèl·lules oclusives i cèl·lules epidèrmiques.
- Graminaci. Estoma format per 2 cèl·lules oclusives envoltades per dues cèl·lules annexes amb forma de lent. Aquest tipus d'estoma es pot trobar en famílies com Cyperaceae i Poaceae.
- Tetracític. Estoma acompanyat per 4 cèl·lules annexes, dues situades als extrems de l'estoma (superior i inferior) i 2 més situades al costat de cada cèl·lula oclusiva. Aquest tipus d'estoma es pot trobar en moltes famílies de monocotiledònies; així i tot. pot trobar-se també en dicotiledònies com el gènere Tilia i espècies de la familia Asclepiadaceae.
- Hexacític. Estoma acompanyat per 6 cèl·lules annexes, dues situades als extrems de l'estoma (superior i inferior), 2 situades al costat de cada cèl·lula oclusiva i les 2 restants situades entre les cèl·lules epidèrmiques i la cèl·lula que acompanya la oclusiva. Aquest tipus d'estoma es troba en algunes famílies de monocotiledònies.
- Actinocític. Les cèl·lules oclusives es troben envoltades com a mínim per 5 cèl·lules annexes produint un cercle amb forma d'estrella. Aquest és un tipus d'estoma rar, es pot trobar en la família Ebenaceae.
- Anisocític o Crucífer. Estoma format per 2 cèl·lules oclusives situades entre 2 cèl·lules annexes on hi ha una que és notablement més petita que l'altra. Aquest tipus d'estoma es troba en més de 30 famílies de dicotiledònies com ara Brassicaceae, Solanaceae i Crassulaceae.
- Anomocític o Ranunculaci. Estoma format per 2 cèl·lules oclusives envoltades per cèl·lules annexes amb la mateixa mida, forma i disposició que la resta de cèl·lules epidèrmiques del voltant. Aquest tipus d'estoma es troba en més de 100 famílies de dicotiledònies com ara Apocynaceae, Boraginaceae, Chenopodiaceae i Cucurbitaceae.
- Diacític o Cariofilaci. Estoma format per 2 cèl·lules oclusives envoltades per 2 cèl·lules annexes. Aquestes envolten les oclusives per la part final de l'obertura (o extrem superior i inferior) i contacten entre elles per la part mitja de l'obertura. Aquest tipus d'estoma es troba en més de 10 famílies de dicotiledònies com ara Caryophyllaceae i Acanthaceae.
- Hemiparacític. L'estoma està envoltat per 1 única cèl·lula annexa diferenciada de la resta de cèl·lules epidèrmiques, amb una llargària paral·lela a la de l'obertura estomàtica. Aquest tipus d'estoma es troba en Molluginaceae i Aizoaceae.
- Paracític o Rubiaci. L'estoma té 1 o varies cèl·lules annexes paral·leles a l'obertura estomàtica que poden sobrepassar o no les cèl·lules oclusives. Aquest tipus d'estoma es pot trobar en més de 100 famílies de dicotiledònies com ara Rubiaceae, Convolvulaceae i Fabaceae.
Estomes i canvi climàtic
modificaResposta dels estomes als factors ambientals
modificaLa fotosíntesi, el transport d'aigua de les plantes (xilema) i l'intercanvi de gasos estan regulats per la funció estomàtica que és important en el funcionament de les plantes.[6]
Els estomes responen a la llum i la llum blava és gairebé 10 vegades més efectiva que la llum vermella per provocar una resposta estomàtica. La investigació suggereix que això es deu al fet que la resposta a la llum dels estomes a la llum blava és independent d'altres components de la fulla com la clorofil·la. Els protoplasts de cèl·lules de protecció s'inflen sota la llum blava sempre que hi hagi prou disponibilitat de potassi.[7] Diversos estudis han vist evidències que l'augment de les concentracions de potassi pot augmentar l'obertura estomàtica al matí, abans que comenci el procés de fotosíntesi, però que més tard al dia la sacarosa té un paper més important en la regulació de l'obertura estomàtica.[8] La zeaxantina a les cèl·lules de guàrdia actua com un fotoreceptor de llum blava que mèdia l'obertura estomàtica.[9] L'efecte de la llum blava sobre les cèl·lules de guàrdia s'inverteix per la llum verda, que isomeritza la zeaxantina.[9]
La densitat estomàtica i l'obertura (longitud dels estomes) varien sota una sèrie de factors ambientals com la concentració de CO2 atmosfèric, la intensitat de la llum, la temperatura de l'aire i el fotoperíode (durada diürna).[10][11]
La disminució de la densitat estomàtica és una de les maneres com les plantes han respost a l'augment de la concentració de CO2 atmosfèric ([CO2]atm).[12] Tot i que els canvis en la resposta [CO2]atm són els menys entesos de manera mecànica, aquesta resposta estomàtica ha començat a aplanar-se on aviat s'espera que afecti els processos de transpiració i fotosíntesi a les plantes.[6][13]
La sequera inhibeix l'obertura estomàtica, però la investigació sobre la soja suggereix que la sequera moderada no té un efecte significatiu en el tancament estomàtic de les seves fulles. Hi ha diferents mecanismes de tancament estomàtic. La baixa humitat estressa les cèl·lules de guàrdia provocant la pèrdua de turgència, anomenada tancament hidropassiu. El tancament hidroactiu es contrasta amb tota la fulla afectada per l'estrès per sequera, que es creu que probablement és provocada per l'àcid abscísic.[14]
Adaptacions futures durant el canvi climàtic
modificaS'espera que el [CO2]atm arribarà a 500–1000 ppm el 2100.[6] El 96% dels últims 400.000 anys ha experimentat menys de 280 ppm de CO2. A partir d'aquesta xifra, és molt probable que els genotips de les plantes actuals hagin divergit dels seus parents preindustrials.[6]
El gen HIC (diòxid de carboni alt) codifica un regulador negatiu per al desenvolupament dels estomes a les plantes.[15] La investigació sobre el gen HIC utilitzant Arabidopsis thaliana no va trobar cap augment del desenvolupament estomàtic en l'al·lel dominant, però en l'al·lel recessiu de tipus salvatge va mostrar un gran augment, com a resposta a l'augment dels nivells de CO2 a l'atmosfera.[15] Aquests estudis impliquen que la resposta de les plantes als nivells canviants de CO2 està controlada en gran manera per la genètica.
Implicacions agrícoles
modificaL'efecte fertilitzant de CO2 s'ha sobreestimat molt durant els experiments d'enriquiment de diòxid de carboni a l'aire lliure (FACE) on els resultats mostren que l'augment dels nivells de CO2 a l'atmosfera millora la fotosíntesi, redueix la transpiració i augmenta l'eficiència de l'ús de l'aigua (WUE).[12] L'augment de la biomassa és un dels efectes amb simulacions d'experiments que prediuen un augment del 5-20% en els rendiments dels cultius a 550 ppm de CO2.[16] Es va demostrar que les taxes de fotosíntesi de les fulles augmentaven entre un 30 i un 50% a les plantes C3 i entre un 10 i un 25% en C4 amb nivells de CO2 duplicats.[16] L'existència d'un mecanisme de retroalimentació dona lloc a una plasticitat fenotípica en resposta a [CO2]atm que podria haver estat un tret adaptatiu en l'evolució de la respiració i la funció de les plantes.[6][11]
Predir com funcionen els estomes durant l'adaptació és útil per entendre la productivitat dels sistemes vegetals tant per als sistemes naturals com per a l'agricultura.[10] Els cultivadors i els agricultors comencen a treballar junts mitjançant la millora evolutiva i participativa de plantes per trobar les espècies més adequades, com ara varietats de cultius resistents a la calor i la sequera, que podrien evolucionar de manera natural cap al canvi davant dels reptes de seguretat alimentària.[12]
Referències
modifica- ↑ Citología e histología vegetal y animal. Volumen 1, Biología celular. Cuarta edición. ISBN 978-84-481-7323-4.
- ↑ Urry, Lisa A.,. Campbell biology. Eleventh edition. ISBN 0-13-409341-0.
- ↑ Paul, Vijay; Sharma, Laxmi; Pandey, Rakesh; R C Meena «Measurement of stomatal density and stomatal index on leaf/plant surfaces». , 2017. DOI: 10.13140/RG.2.2.13426.40646.
- ↑ Metcalfe, C.R.; Chalk, L. (1950). Anatomy of Dicotyledons. 1: Leaves, Stem, and Wood in relation to Taxonomy, with notes on economic Uses.
- ↑ Cotthem, W. R. J. «A classification of stomatal types» (en anglès). Botanical Journal of the Linnean Society, 63, 3, 1970-07, pàg. 235–246. DOI: 10.1111/j.1095-8339.1970.tb02321.x.
- ↑ 6,0 6,1 6,2 6,3 6,4 Rico, C; Pittermann, J; Polley, HW; Aspinwall, MJ; Fay, PA New Phytologist, 199, 4, 2013, pàg. 956–965. DOI: 10.1111/nph.12339. PMID: 23731256 [Consulta: free].
- ↑ McDonald, Maurice S. Photobiology of Higher Plants. Wiley, 2003, p. 293. ISBN 978-0-470-85523-2.
- ↑ Mengel. Principles of Plant Nutrition. Springer, 2001, p. 205. DOI 10.1007/978-94-010-1009-2. ISBN 978-94-010-1009-2.
- ↑ 9,0 9,1 Kochhar, S. L.. «Transpiration». A: Plant Physiology: Theory and Applications. 2. Cambridge University Press, 2020, p. 75–99. DOI 10.1017/9781108486392.006. ISBN 978-1-108-48639-2.
- ↑ 10,0 10,1 Buckley, TN; Mott, KA Plant, Cell and Environment, 36, 9, 2013, pàg. 1691–1699. DOI: 10.1111/pce.12140. PMID: 23730938 [Consulta: free].
- ↑ 11,0 11,1 Rogiers, SY; Hardie, WJ; Smith, JP Australian Journal of Grape and Wine Research, 17, 2, 2011, pàg. 147–152. DOI: 10.1111/j.1755-0238.2011.00124.x.
- ↑ 12,0 12,1 12,2 Ceccarelli, S; Grando, S; Maatougui, M; Michael, M; Slash, M The Journal of Agricultural Science, 148, 6, 2010, pàg. 627–637. DOI: 10.1017/s0021859610000651 [Consulta: free].
- ↑ Serna, L; Fenoll, C Nature, 408, 6813, 2000, pàg. 656–657. DOI: 10.1038/35047202. PMID: 11130053.
- ↑ Mengel. Principles of Plant Nutrition. Springer, 2001, p. 223. DOI 10.1007/978-94-010-1009-2. ISBN 978-94-010-1009-2.
- ↑ 15,0 15,1 Gray, J; Holroyd, G; van der Lee, F; Bahrami, A; Sijmons, P Nature, 408, 6813, 2000, pàg. 713–716. Bibcode: 2000Natur.408..713G. DOI: 10.1038/35047071. PMID: 11130071.
- ↑ 16,0 16,1 Tubiello, FN; Soussana, J-F; Howden, SM Proceedings of the National Academy of Sciences of the United States of America, 104, 50, 2007, pàg. 19686–19690. Bibcode: 2007PNAS..10419686T. DOI: 10.1073/pnas.0701728104. PMC: 2148358. PMID: 18077401 [Consulta: free].