Ressonància (química)
La ressonància és una propietat que tenen unes certes substàncies de no poder ser representades per una única fórmula d'estructura de tipus convencional que sigui capaç de definir-ne les propietats d'una forma característica. És anomenada també mesomeria, que prové del grec μέσος i que significa mitjà.[1]
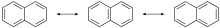
Hom defineix un compost que presenta mesomeria com un híbrid de ressonància o estat mesomèric d'una mateixa substància, la fórmula de la qual aleshores és representada mitjançant la de les diverses formes possibles separades amb el signe ↔.

Un exemple molt il·lustratiu és el de l'anió carbonat, el qual pot representar-se per tres estructures diferents que són equivalents. Aquestes estructures només es diferencien entre elles per la posició dels electrons. Són estructures ressonants i l'anió carbonat no està descrit per cap d'elles sinó com un híbrid de ressonància de totes elles. Els enllaços de l'anió carbonat no són enllaços simples o dobles sinó que són enllaços formats per una part i un terç i tots són equivalents. Aquesta predicció de la teoria està confirmada per l'evidència física. Tots els enllaços de l'anió carbonat tenen la mateixa longitud i està entre la dels enllaços simples C-O i la dels dobles C=O. Els oxígens de l'anió carbonat tenen tots una càrrega negativa parcial, és a dir, 2/3 d'una càrrega negativa.[2]

Per tant les formes mesòmeres, dites també formes límit o en ressonància, d'una mateixa substància difereixen per la distribució dels electrons d'enllaç, alguns dels quals es desplacen d'àtom, bé que els àtoms ocupen les mateixes posicions en totes dues formes. Cal dir que l'estat real de la molècula és, de fet, intermedi entre els estats representats per cadascuna de les estructures, però cadascuna de les formes de ressonància per separat no té realitat física o existència independent. És a dir, que la molècula no existeix en formes diferents, i la representació de l'estructura electrònica no pot ser feta amb una única distribució de Lewis, sinó que és intermèdia a la indicada per les diverses formes límit.
Mitjançant mesures experimentals de les entalpies de combustió ha estat posat de manifest que les molècules amb ressonància presenten una energia inferior a la prevista pel càlcul. Aquesta diferència d'energia és anomenada energia d'estabilització o de ressonància.[3]
Història
modificaEl fenomen de la ressonància va ser descobert pels físics Werner Heisenberg[4] i Paul Adrien Maurice Dirac[5] el 1926. Després va ser emprat pel químic nord-americà Linus Pauling per explicar enllaços de molècules com ara el H₂+,[6] el benzè, el naftalè,[7] etc.
El terme alternatiu que sol aparèixer en la literatura, mesòmer, és molt popular a les publicacions realitzades en idiomes alemany i francès i va ser introduït pel químic anglès Christopher Kelk Ingold el 1938 que en aquella època no va ser un concepte capturat en la literatura científica en anglès. El símbol de la doble fletxa, , va ser introduït pel químic alemany Fritz Arndt qui va denominar a aquest efecte en alemany com zwischenstufe que és com a fase intermèdia.
Exemples
modifica- La molècula d'ozó es representa per dues estructures ressonants a la part superior de la figura. En realitat els dos àtoms d'oxigen terminals són equivalents i formen una estructura híbrida que es representa a la dreta amb -1/2 indicant que la càrrega es reparteix entre els dos àtoms d'oxigen i els enllaços dobles parcials.
- El benzè es coneix des del 1825 i és un dels composts més estudiats i coneguts. L'estructura del benzè va suposar un problema extraordinàriament difícil pels primers químics orgànics, no perquè tingués una complicació excessiva, sinó més aviat per ser el primer cas d'enllaços deslocalitzats amb el qual es toparen que no encaixava amb els coneixements que es tenien de l'estructura molecular. La molècula de benzè presenta sis enllaços covalents que haurien de ser diferents, tres simples i 3 dobles, basant-se en les representacions que s'empren habitualment, però són exactament iguals (longitud, força). Per una altra banda el benzè resulta molt més estable que composts semblants amb enllaços simples i dobles. El resultat de les intenses investigacions conduïren als químics a la conclusió que la parella de fórmules proposades pel químic Friederich August Kekulé era la millor representació pel benzè. No va ser possible comprendre per quina raó es necessitaven dues fórmules per descriure l'estructura del benzè fins que varen aparèixer els conceptes d'electrons deslocalitzats i de ressonància.[8] L'aclariment de l'estructura del benzè es deu a Linus Pauling que el 1933 aplicà la teoria d'enllaç de valència per a explicar-la i, especialment, el concepte de ressonància.[7] Les estructures de Kekulé, i d'altres, són representacions excessivament simplificades de la realitat, però la molècula real es pot interpretar com una combinació de les estructures proposades.
- El catió del grup al·lil (part inferior de l'esquema) té dues formes ressonants mitjançant l'enllaç doble que fa que la càrrega positiva estigui deslocalitzada al llarg de tot el catió del grup al·lil.
Referències
modifica- ↑ Klages, F. Tratado de Química Orgánica. Tomo I (en castellà). 1ª. Barcelona: Reverté, 1969. ISBN 8429173110.
- ↑ Solomons, T.W.G. Química orgánica (en castellà). Mèxic: Limusa, 1982. ISBN 968-18-0982-3.
- ↑ Enciclopèdia Catalana. L'Enciclopèdia, 1999.
- ↑ Heisenberg, W Z. f. Physik, 38, 1926, pàg. 411.
- ↑ Dirac, P.A.M Proc. Roy. Soc. London, A., 112, 1926, pàg. 661.
- ↑ Pauling, L «The application of the Quantum Mechanics to the Structure of the Hydrogen Molecule and the Hidrogen Molecule-ion and to Related Problems». Chemical Reviews, V, 2, 6-1928, pàg. 173-213.
- ↑ 7,0 7,1 Pauling, L.; Wheland, G.W «The nature of the chemical bond. V. The quantum-mechanical calculation of the resonance energy of benzene and naphthalene and the hydrocarbon free radicals». J. Chem. Phys., 1, 6-1933, pàg. 362-374.
- ↑ Allinger, N.L. [et al.].. Química orgánica (en castellà). I. Barcelona: Reverté, 1984. ISBN 84-291-7016-2.