Tirosina hidroxilasa
La tirosina hidroxilasa (TH), també denominada tirosina 3-monooxigenasa, és un enzim que catalitza la reacció de síntesi d'un grup d'hormones anomenat catecolamines a les glàndules suprarenals. Concretament, la tirosina hidroxilasa catalitza la conversió de l'aminoàcid L-tirosina a L-3,4-dihidroxifenilalanina (DOPA). La DOPA és la molècula precursora de la dopamina, a partir de la qual són sintetitzades la noradrenalina (o norepinefrina) i l'epinefrina. La dopamina, la noradrenalina i l'epinefrina són importants neurotransmissors del sistema nerviós autònom, que controla processos involuntaris com la regulació de la pressió sanguínia i de la temperatura corporal.
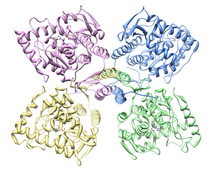
Aquest enzim és codificat pel gen TH, que es troba al cromosoma 11 en la posició 15.5.[1] El gen de la TH en humans està format per 14 exons separats per 13 introns, que després de la seva traducció dona lloc a 4 isoformes diferents que difereixen en la seva estructura peptídica.[2]

| « | Life cannot have had a random beginning… The trouble is that there are about two thousand enzymes, and the chance of obtaining them all in a random trial is only one part in 1040,000, an outrageously small probability that could not be faced even if the whole universe consisted of organic soup.
La vida no pot haver tingut un començament aleatori ... El problema és que hi ha uns dos mil enzims, i la possibilitat d'obtenir-los tots en un experiment aleatori és només una part entre 1040,000, una probabilitat escandalosament petita que no es podria fer front encara que tot l'univers consistís en una sopa orgànica. |
» |
| — Fred Hoyle and N. Chandra Wickramasinghe, Evolution from Space (London: J.M. Dent & Sons, 1981) | ||
Reacció catalitzada
modificaLa tirosina hidroxilasa, catalitza la reacció en la qual la L-tirosina s'hidroxila a la meta posició, per obtenir L-3,4-dihidroxifenilalanina (L-DOPA). L'enzim és una oxigenasa, és a dir, utilitza oxigen molecular per a hidroxilitzar els substrats. Per una banda, un dels àtoms d'oxigen de l'O2, s'utilitza per a hidroxilar la molècula de tirosina per acabar obtenint L-DOPA. Per altra banda, la segona finalitat és hidroxilar el cofactor. Igual que les altres hidroxilases d'aminoàcids aromàtics (AAAH), la tirosina hidroxilasa utilitza el cofactor tetrahidrobiopterina (BH4) en condicions normals, encara que altres molècules similars també poden funcionar com a cofactor per a la tirosina hidroxilasa.[3]
Degut a les similituds dels llocs actius, no és sorprenent que l'especificitat que trobem en el substrat dels dos enzims no siguin absolutes. La TrpH fàcilment hidroxilitza tant triptòfan com fenilalanina. Per contra, l'hidroxilació de la tirosina és d'aproximadament 5.000 vegades més lenta.[4]
Les AAAH converteixen el cofactor 5,6,7,8-tetrahidrobiopterina (BH4) en tetrahidrobiopterin-4a-carbinolamina (4a-BH4). Sota condicions fisiològiques, la 4a-BH4 es deshidrata a quinonoid-dihidrobiopterina (q-BH2) per l'enzim pterin-4a-carbinolamina deshidrasa (PCD) i s'allibera una molècula d'aigua en aquesta reacció. A continuació, l'enzim dihidropteridina reductasa (DHPR) enzimàtic NAD (P) H converteix q-BH2 de tornada a BH4. Cadascuna de les quatre subunitats de la tirosina hidroxilasa es coordina amb un àtom de ferro (II) presentat en el lloc actiu. L'estat d'oxidació d'aquest àtom de ferro és important per a la recanvi catalític en la reacció enzimàtica. Si el ferro s'oxida a Fe (III), l'enzim està inactiu.[5]
El producte de la reacció enzimàtica, L-DOPA, es pot transformar a dopamina per l'enzim DOPA decarboxilasa. La dopamina pot convertir-se en norepinefrina per l'enzim dopamina β-hidroxilasa, que pot ser modificada per l'enzima feniletanol N-metiltransferasa per obtenir l'epinefrina. Atès que L-DOPA és el precursor dels neurotransmissors dopamina, noradrenalina i adrenalina, la tirosina hidroxilasa es troba, doncs, al citosol de totes les cèl·lules que contenen aquestes catecolaminas. Aquesta reacció inicial catalitzada per tirosina hidroxilasa s'ha demostrat que és el pas limitador de la velocitat en la producció de catecolamines.[6]
L'enzim és altament específic, sense acceptar els derivats d'indol, cosa que és inusual, ja que molts altres enzims implicats en la producció de catecolamines. El triptòfan és un substrat pobre per a la tirosina hidroxilasa, però pot hidroxilar L-fenilalanina per formar L-tirosina i petites quantitats de 3-hidroxifenilalanina. L'enzim pot catalitzar posteriorment la L-tirosina per formar L-DOPA. La tirosina hidroxilasa també pot estar implicada en altres reaccions, com l'oxidació de L-DOPA per formar 5-S-cisteinil-DOPA o altres derivats L-DOPA.[7]
Estructura i característiques de l'enzim
modificaLa tirosina hidroxilasa té una massa atòmica de 240 kDa i està formada per quatre subunitats idèntiques de 60kDa, és a dir, és un homotetràmer. Cada subunitat consta de dos dominis, un catalític i un regulador.
El domini catalític que correspon a l'extrem C-terminal és el més conservat en l'evolució i on es troba unit el cofactor. També és on interaccionen el coenzim i el substrat durant la catàlisi. En aquest terminal carboxil de la cadena peptídica hi ha un domini amb alfa hèlix curt que permet la tetramerització. Té 300 aminoàcids centrals que formen un nucli catalític on hi ha tots els residus que es necessiten per a la catàlisi, enllaçat no covalentment amb un àtom de ferro. El ferro es manté anclat al seu lloc gràcies a dos residus d'histidina i un de glutamat, convertint-lo en un cofactor.[8]
L'amino terminal,150 aminoàcids, constitueix un domini regulador, pensat per a controlar l'accés dels substrats al centre actiu, és a dir, té un efecte inhibidor sobre l'activitat enzimàtica. Aquesta inhibició desapareix quan s'activa l'enzim mitjançant fosforilació de residus de serina situats a Ser8, Ser19, Ser31, Ser40 i Ser153. Aquestes fosforilacions es duen a terme per cinases que segueixen diferents mecanismes de regulació.[2] Aquests són complexes, ja que, per exemple, una mateixa cinasa que fosforila en la Ser31 de la isoforma 1 de la tirosina hidroxilasa no ho pot fer en la Ser35 (la que correspon a la Ser31 en l'altra isoforma) de la isoforma 2 de l'enzim.[9]
En humans, es dedueix que hi ha quatre versions diferents d'aquest domini regulador i, per tant, quatre versions d'aquest enzim, depenent de l'empalmament alternatiu, encara que cap d'aquestes estructures de moment s'ha pogut determinar correctament. Diversos estudis i investigacions han suggerit que aquest domini podria ser una proteïna intrínsecament no estructurada, que no té una estructura terciària clarament definida, però fins ara no s'ha presentat cap evidència que recolzi aquesta afirmació.[10] Tanmateix, s'ha demostrat que el domini té una baixa ocurrència d'estructures secundàries, que no debilita les sospites que tenen una estructura general desordenada. Quant a la tetramerització i els dominis catalítics, la seva estructura es va trobar amb la tirosina hidroxilasa de la rata mitjançant la cristalografia de raigs X. Això ha demostrat que la seva estructura és molt similar a la de la fenilalanina hidroxilasa i al triptòfan hidroxilasa (especialment s'assemblen en l'estructura primària i en la catàlisi).[11] Els tres junts, constitueixen una família d'hidroxilases d'aminoàcids aromàtics homòlegs.[12] Aquests enzims utilitzen tetrahidrobiopterina com a coenzim i ferro (II) no unit a un grup hemo com cofactor.[13]
Regulació
modificaL'activitat de la tirosina hidroxilasa augmenta a curt termini gràcies a la fosforilació. El domini regulador de la tirosina hidroxilasa conté múltiples residus de serina (Ser), com Ser8, Ser19, Ser31 i Ser 40, els quals són fosforilats per una gran varietat de proteïnes cinases.[14][15] Aquestes forforilacions estan ordenades de forma jeràrquica (per exemple, gràcies a la fosforilació de Ser19 en el N-terminal, s'augmenta la fosforilació de Ser40) i depenen de l'estat del substrat.[16] La via de degradació per part dels proteosomes sembla estar connectada amb aquestes fosforilacions jeràrquiques, ja que aquests proteosomes inhibits no degraden la tirosina hidroxilasa amb fosforilacions de Ser19, sinó que a partir d'aquí s'indueix la fosforilació de Ser19 i, en conseqüència, la de totes les dues formes de tirosina hidroxilasa (Ser40, Ser31). Quan s'activa el proteosoma, es degraden només els enzims fosforilats en Ser19, essent aquesta la fosforilació clau en la degradació de l'enzim per la via proteosòmica.[17]
El residu Ser40 és fosforilat per la cAMP-dependent proteïna-cinasa.[18] Ser19 (i en menys quantitat Ser40) és forsforilat per la calci-calmodulina-dependent proteïna-cinasa.[19] MAPKAPK2 (mitògen-proteïna-activada cinasa-activadora proteïna-cinasa) té preferència per Ser40, però també fosforila Ser19 al voltant de la meitat de la taxa de Ser40.[16][20] Ser31 és fosforilat per ERK1 i ERK2 (cinases 1&2 extracel·lulars regulades),[21] i incrementa molt menys l'activitat de l'enzim que amb la fosforilació del residu Ser40.[16] La fosforilació de Ser19 i Ser8 no té un efecte directe en l'activitat de la tirosina hidroxilasa, però la fosforilació de Ser19 incrementa la taxa de fosforilació de Ser40, la qual sí augmenta l'activitat de l'enzim. La forforilació de Ser19 causa un doble increment d'activitat,mitjançant un mecanisme que requereix les proteïnes 14-3-3.[22] La fosforilació de Ser31 causa un lleuger augment de l'activitat, mitjançant un mecanisme desconegut. Tot i així, se sap que aquesta fosforilació augmenta a la glàndula suprarenal en presència de quantitats més elevades d'insulina, de forma que la tirosina hidroxilasa s'activa molt més i indueix la síntesi de catecolamines en la medul·la suprarenal (i també a les zones catecolaminèrgiques del cervell). Per tant, és possible que la fosforilació de Ser31 sigui un mecanisme de defensa psicològica en casos d'hipoglucèmia.[23] També se sap que la fosforilació de Ser31 i Ser40 s'incrementa per la hipòxia, tant a llarg com a curt termini,[24] o davant la presència de determinats agents estressants.[25]
La tirosina hidroxilasa s'estabilitza per inactivació calorífica quan es dona la fosforilació de les serines reguladores.[16][26] La tirosina hidroxilasa està principalment present en el citosol, encara que també es troba en certa manera en la membrana plasmàtica.[27] L'associació de membranes pot estar relacionada amb l'empaquetatge de catecolamina en vesícules i l'exportació a través de la membrana sinàptica.[27] En la unió de la tirosina hidroxilasa a les membranes participa la regió N-terminal de l'enzim, i pot ser regulada per una interacció triple entre proteïnes 14-3-3, la regió N-terminal de la tirosina hidroxilasa i membranes carregades negativament.[28] Aquesta és una altra mostra de la meticulosa regulació d'aquest enzim i de les fosforilacions jeràrquiques. Les diferents tirosines hidroxilases fosforilades i les proteïnes 14-3-3 formen complexes per activar l'enzim i estabilitzar-lo. Mentre que la tirosina hidroxilasa fosforilada en Ser19 amb forma tetramèrica té gran afinitat per la proteïna 14-3-3γ, la interacció amb la tirosina hidroxilasa fosforilada en Ser40 i les proteïnes 14-3-3γ és dèbil. És per això que aquestes proteïnes inhibeixen la taxa de fosforilació de Ser40, mostrant que aquesta no és essencial en la unió tirosina hidroxilasa-proteïna 14-3-3 com ho és la fosforilació en Ser19. La tirosina hidroxilasa tetramèrica fosforilada en Ser19 forma complexes amb les proteïnes 14-3-3γ d'un (asimètric) i dos (simètric) dímers, amb una major freqüència d'asimètrics.[29]
La tirosina hidroxilasa també es pot regular per inhibició. La fosforilació de Ser40 alleugera la inhibició feedback per les catecolamines dopamina, epinefrina i norepinefrina,[30][31] les quals estan relacionades amb l'estrès i l'obesitat.[25] La unió de la tirosina hidroxilasa a les catecolamines provoca una incorporació deutoriònica més baixa en el domini catalític, cosa que no succeix amb les fosforilacions.[32] Les catecolamines atrapen el ferro del centre actiu en l'estat Fe (III), inhibint l'enzim.[13] Hi ha dos parts a l'enzim: una amb poca afinitat per la dopamina (i que està activa independentment de les fosforilacions de Ser40) i una altra amb molta afinitat (el ja esmentat domini regulador en l'extrem N-terminal).[33] S'ha demostrat també que l'expressió de la tirosina hidroxilasa pot veure’s afectada per l'expressió de SRY. Una baixada del gen SRY a la substància negra pot provocar una disminució de l'expressió de tirosina hidroxilasa.[34]
La regulació a llarg termini de la tirosina hidroxilasa també pot estar mediada per mecanismes de fosforilació. Les hormones (p. Ex., glucocorticoides), drogues (p. Ex., cocaïna) o segons missatgers com l'cAMP augmenten la transcripció de la tirosina hidroxilasa. L'augment de l'activitat de la tirosina hidroxilasa a causa de la fosforilació pot ser mantinguda per nicotina fins a 48 hores.[13][35] L'activitat de la tirosina hidroxilasa es regula crònicament (dies) per síntesi de proteïnes.[35] Tanmateix, cal esmentar que també poden existir altres mecanismes diferents a la fosforilació en la regulació de l'activitat de l'enzim, especialment en ambients on l'Amfetamina i la hiperactivitat són presents.[36]
Importància clínica
modificaUna deficiència de tirosina hidroxilasa suposa una disminució en la producció de dopamina, epinefrina i norepinefrina. Aquest fet suposa una encefalopatia progressiva i un pronòstic desfavorable. Les característiques clíniques de la deficiència de l'enzim inclouen distonia que respon mínimament a la levodopa o que no hi respon, símptomes extrapiramidals, ptosis, miosis i hipotensió postural. Aquesta condició pot millorar gràcies al tractament amb levodopa però no pot ser curada.[37] S'han identificat més d'una dotzena de mutacions en el gen de la tirosina hidroxilasa (TH) que causen distonia, que és un trastorn neurològic del moviment. La gran majoria de les mutacions del gen TH suposen un canvi en els aminoàcids que constitueixen la tirosina hidroxilasa. Com a conseqüència, l'enzim experimenta una disminució de la seva funcionalitat i, això, al seu torn, suposa una disminució de la producció de dopamina. Els individus amb aquesta condició experimenten contraccions musculars involuntàries, tremolors i altres tipus de moviments incontrolats a causa dels baixos nivells de dopamina. Depenent de la funcionalitat de l'enzim, els símptomes poden ser més o menys severs.[1][38] Per exemple, determinades mutacions en el cor del tetràmer, on hi ha una hèlix superenrotllada, podrien afectar a l'estructura de l'enzim, cosa que provocaria malalties com la distonia dopa-sensible o la síndrome de Segawa.[11] Altres alteracions en l'activitat de l'enzim podrien estar relacionades amb malalties com la malaltia de Parkinson, la malaltia d'Alzheimer, l'esquizofrènia i la malaltia de Huntington.[39][40] A més, la tirosina hidroxilasa és un autoantigen de la síndrome poliglandular autoimmune tipus I.[41]
Per una altra banda, un avantatge de la tirosina hidroxilasa, entre d'altres, és el fet que el seu increment provoqui una estimulació en les funcions de l'hipocamp per part de la vitamina B6.[42]
La tirosina hidroxilasa també ha estat associada amb l'estrès crònic i la memòria a curt termini en estudis recents. Aquesta molècula és responsable de la síntesi d'importants neurotransmissors com ara la noradrenalina i la dopamina. Aquestes catecolamines són crucials pel correcte funcionament del còrtex prefrontal, que és la regió cerebral que s'ocupa de la memòria a curt termini. Es pensa que els efectes de l'estrès crònic en la memòria a curt termini podrien estar causats per alteracions en la transmissió de noradrenalina i dopamina en el còrtex prefrontal.[43]
Altres estudis mostren la relació entre la deficiència de tirosina hidroxilasa i la síndrome de distonia mioclònica, que es tracta d'una rara malaltia autosòmica dominant. Aquesta malaltia típicamente afecta el coll, el tronc i els braços. Una gran part de les persones afectades per aquesta síndrome també desenvolupen trastorns psicològics com ara depressió, ansietat, atacs de pànic i trastorn obsessivocompulsiu (TOC).[44][45]
La metirosina pot inhibir la tirosina hidroxilasa i, conseqüentment, causar una disminució en la producció de dopamina i norepinefrina al cervell a causa de la manca del precursor L-DOPA, que és sintetizat per l'enzim. Aquesta droga pot causar depressió i és utilitzada en poco casos tot i que és efectiva en el tractament de feocromocitoma i de la hipertensió. Altres inhibidors de la tirosina hidroxilasa són l'oudenona[46] i l'aquayamicina.[47]
Referències
modifica- ↑ 1,0 1,1 Reference, Genetics Home. «TH gene» (en anglès). [Consulta: 26 octubre 2017].
- ↑ 2,0 2,1 Goldstein M, Lieberman A; Lieberman, A «The role of the regulatory enzymes of catecholamine synthesis in Parkinson's disease.». Neurology, 42, 4 Suppl 4, abril 1992, pàg. 8-12; discussion 41-8. PMID: 1350074.
- ↑ Martinez, Knut Teigen, Jeffrey Alan McKinney, Jan Haavik and Aurora «Selectivity and Affinity Determinants for Ligand Binding to the Aromatic Amino Acid Hydroxylases» (en anglès). Current Medicinal Chemistry, 14, 4, 31-01-2007.
- ↑ «FMPMC-PS - Composés azotés - Objectifs au cours de Biochimie DCEM3 Biochimie métabolique et Régulations C1». Arxivat de l'original el 2007-08-12. [Consulta: 22 octubre 2017].
- ↑ Thöny, Beat; Auerbach, Günter; Blau, Nenad «Tetrahydrobiopterin biosynthesis, regeneration and functions» (en anglès). Biochemical Journal, 347, 1, 01-04-2000, pàg. 1–16. DOI: 10.1042/bj3470001. ISSN: 0264-6021. PMID: 10727395.
- ↑ «les catécholamines». [Consulta: 22 octubre 2017].
- ↑ Haavik, Jan; Flatmark, Torgeir «Isolation and characterization of tetrahydropterin oxidation products generated in the tyrosine 3-monooxygenase (tyrosine hydroxylase) reaction» (en anglès). European Journal of Biochemistry, 168, 1, 01-10-1987, pàg. 21–26. DOI: 10.1111/j.1432-1033.1987.tb13381.x. ISSN: 1432-1033.
- ↑ Kobayashi, Kazuto; Kaneda, Norio; Ichinose, Hiroshi; Kishi, Fumio; Nakazawa, Atsushi «Isolation of a full-length cDNA clone encoding human tyrosine hydroxylase type 3». Nucleic Acids Research, 15, 16, 25-08-1987, pàg. 6733–6733. DOI: 10.1093/nar/15.16.6733. ISSN: 0305-1048.
- ↑ Gordon SL, Bobrovskaya L, Dunkley PR, Dickson PW; Bobrovskaya, L; Dunkley, PR; Dickson, PW «Differential regulation of human tyrosine hydroxylase isoforms 1 and 2 in situ: Isoform 2 is not phosphorylated at Ser35.». Biochimica et biophysica acta, 1793, 12, desembre 2009, pàg. 1860-7. DOI: 10.1016/j.bbamcr.2009.10.001. PMID: 19833152.
- ↑ Craig, S.P.; Buckle, V.J.; Lamouroux, A.; Mallet, J.; Craig, I. «Localization of the human tyrosine hydroxylase gene to 11p15: gene duplication and evolution of metabolic pathways» (en anglès). Cytogenetic and Genome Research, 42, 1-2, 1986, pàg. 29–32. DOI: 10.1159/000132246. ISSN: 1424-8581.
- ↑ 11,0 11,1 Goodwill KE, Sabatier C, Marks C, Raag R, Fitzpatrick PF, Stevens RC; Sabatier, C; Marks, C; Raag, R; Fitzpatrick, PF; Stevens, RC «Crystal structure of tyrosine hydroxylase at 2.3 A and its implications for inherited neurodegenerative diseases.». Nature structural biology, 4, 7, juliol 1997, pàg. 578-85. PMID: 9228951.
- ↑ Vrana, Kent E.; Walker, Stephen J.; Rucker, Paul; Liu, Xuan «A Carboxyl Terminal Leucine Zipper Is Required for Tyrosine Hydroxylase Tetramer Formation» (en anglès). Journal of Neurochemistry, 63, 6, 01-12-1994, pàg. 2014–2020. DOI: 10.1046/j.1471-4159.1994.63062014.x. ISSN: 1471-4159.
- ↑ 13,0 13,1 13,2 Haavik J, Toska K; Toska, K «Tyrosine hydroxylase and Parkinson's disease.». Molecular neurobiology, 16, 3, juny 1998, pàg. 285-309. DOI: 10.1007/BF02741387. PMID: 9626667.
- ↑ Fitzpatrick PF «Tetrahydropterin-dependent amino acid hydroxylases». Annual Review of Biochemistry, 68, 1999, pàg. 355–81. DOI: 10.1146/annurev.biochem.68.1.355. PMID: 10872454 [Consulta: 15 octubre 2017].
- ↑ Haycock JW «Phosphorylation of tyrosine hydroxylase in situ at serine 8, 19, 31, and 40». The Journal of Biological Chemistry, 265, 20, juliol 1990, pàg. 11682–91. PMID: 1973163 [Consulta: 15 octubre 2017].
- ↑ 16,0 16,1 16,2 16,3 Dunkley PR, Bobrovskaya L, Graham ME, von Nagy-Felsobuki EI, Dickson PW; Bobrovskaya, L; Graham, ME; von Nagy-Felsobuki, EI; Dickson, PW «Tyrosine hydroxylase phosphorylation: regulation and consequences.». Journal of neurochemistry, 91, 5, desembre 2004, pàg. 1025-43. DOI: 10.1111/j.1471-4159.2004.02797.x. PMID: 15569247.
- ↑ Nakashima A, Ohnuma S, Kodani Y, Kaneko YS, Nagasaki H, Nagatsu T, Ota A; Ohnuma, S; Kodani, Y; Kaneko, YS; Nagasaki, H; Nagatsu, T; Ota, A «Inhibition of deubiquitinating activity of USP14 decreases tyrosine hydroxylase phosphorylated at Ser19 in PC12D cells.». Biochemical and biophysical research communications, 472, 4, 15-04-2016, pàg. 598-602. DOI: 10.1016/j.bbrc.2016.03.022. PMID: 26969276.
- ↑ Roskoski R, Roskoski LM «Activation of tyrosine hydroxylase in PC12 cells by the cyclic GMP and cyclic AMP second messenger systems». Journal of Neurochemistry, 48, 1, gener 1987, pàg. 236–42. DOI: 10.1111/j.1471-4159.1987.tb13153.x. PMID: 2878973 [Consulta: 15 octubre 2017].
- ↑ Lehmann IT, Bobrovskaya L, Gordon SL, Dunkley PR, Dickson PW «Differential regulation of the human tyrosine hydroxylase isoforms via hierarchical phosphorylation». The Journal of Biological Chemistry, 281, 26, juny 2006, pàg. 17644–51. DOI: 10.1074/jbc.M512194200. PMID: 16644734.
- ↑ Sutherland C, Alterio J, Campbell DG, Le Bourdellès B, Mallet J, Haavik J, Cohen P; Alterio, J; Campbell, DG; Le Bourdellès, B; Mallet, J; Haavik, J; Cohen, P «Phosphorylation and activation of human tyrosine hydroxylase in vitro by mitogen-activated protein (MAP) kinase and MAP-kinase-activated kinases 1 and 2.». European journal of biochemistry, 217, 2, 15-10-1993, pàg. 715-22. DOI: 10.1111/j.1432-1033.1993.tb18297.x. PMID: 7901013.
- ↑ Haycock JW, Ahn NG, Cobb MH, Krebs EG; Ahn, NG; Cobb, MH; Krebs, EG «ERK1 and ERK2, two microtubule-associated protein 2 kinases, mediate the phosphorylation of tyrosine hydroxylase at serine-31 in situ.». Proceedings of the National Academy of Sciences of the United States of America, 89, 6, 15-03-1992, pàg. 2365-9. DOI: 10.1073/pnas.89.6.2365. PMID: 1347949.
- ↑ Ichimura T, Isobe T, Okuyama T, Takahashi N, Araki K, Kuwano R, Takahashi Y; Isobe, T; Okuyama, T; Takahashi, N; Araki, K; Kuwano, R; Takahashi, Y «Molecular cloning of cDNA coding for brain-specific 14-3-3 protein, a protein kinase-dependent activator of tyrosine and tryptophan hydroxylases.». Proceedings of the National Academy of Sciences of the United States of America, 85, 19, octubre 1988, pàg. 7084-8. DOI: 10.1073/pnas.85.19.7084. PMID: 2902623.
- ↑ Senthilkumaran M, Johnson ME, Bobrovskaya L; Johnson, ME; Bobrovskaya, L «The Effects of Insulin-Induced Hypoglycaemia on Tyrosine Hydroxylase Phosphorylation in Rat Brain and Adrenal Gland.». Neurochemical research, 41, 7, juliol 2016, pàg. 1612-24. DOI: 10.1007/s11064-016-1875-3. PMID: 26935743.
- ↑ Kato K, Yamamoto Y; Yamamoto, Y «Short-term hypoxia increases phosphorylated tyrosine hydroxylase at Ser31 and Ser40 in rat carotid body.». Respiratory physiology & neurobiology, 185, 3, 01-02-2013, pàg. 543-6. DOI: 10.1016/j.resp.2012.11.004. PMID: 23153692.
- ↑ 25,0 25,1 Ong LK, Guan L, Stutz B, Dickson PW, Dunkley PR, Bobrovskaya L.; Guan, L; Stutz, B; Dickson, PW; Dunkley, PR; Bobrovskaya, L «The effects of footshock and immobilization stress on tyrosine hydroxylase phosphorylation in the rat locus coeruleus and adrenal gland.». Neuroscience, 192, 29-09-2011, pàg. 20-7. DOI: 10.1016/j.neuroscience.2011.06.087. PMID: 21767616.
- ↑ Royo M, Fitzpatrick PF, Daubner SC; Fitzpatrick, PF; Daubner, SC «Mutation of regulatory serines of rat tyrosine hydroxylase to glutamate: effects on enzyme stability and activity.». Archives of biochemistry and biophysics, 434, 2, 15-02-2005, pàg. 266-74. DOI: 10.1016/j.abb.2004.11.007. PMID: 15639226.
- ↑ 27,0 27,1 Chen R, Wei J, Fowler SC, Wu JY; Wei, J; Fowler, SC; Wu, JY «Demonstration of functional coupling between dopamine synthesis and its packaging into synaptic vesicles.». Journal of biomedical science, 10, 6 Pt 2, 2002, pàg. 774-81. DOI: 10.1159/000073965. PMID: 14631117.
- ↑ Halskau Ø, Ying M, Baumann A, Kleppe R, Rodriguez-Larrea D, Almås B, Haavik J, Martinez A; Ying, M; Baumann, A; Kleppe, R; Rodriguez-Larrea, D; Almås, B; Haavik, J; Martinez, A «Three-way interaction between 14-3-3 proteins, the N-terminal region of tyrosine hydroxylase, and negatively charged membranes.». The Journal of biological chemistry, 284, 47, 20-11-2009, pàg. 32758-69. DOI: 10.1074/jbc.M109.027706. PMID: 19801645.
- ↑ Kleppe R, Rosati S, Jorge-Finnigan A, Alvira S, Ghorbani S, Haavik J, Valpuesta JM, Heck AJ, Martinez A; Rosati, S; Jorge-Finnigan, A; Alvira, S; Ghorbani, S; Haavik, J; Valpuesta, JM; Heck, AJ; Martinez, A «Phosphorylation dependence and stoichiometry of the complex formed by tyrosine hydroxylase and 14-3-3γ.». Molecular & cellular proteomics : MCP, 13, 8, agost 2014, pàg. 2017-30. DOI: 10.1074/mcp.M113.035709. PMID: 24947669.
- ↑ Daubner SC, Lauriano C, Haycock JW, Fitzpatrick PF; Lauriano, C; Haycock, JW; Fitzpatrick, PF «Site-directed mutagenesis of serine 40 of rat tyrosine hydroxylase. Effects of dopamine and cAMP-dependent phosphorylation on enzyme activity.». The Journal of biological chemistry, 267, 18, 25-06-1992, pàg. 12639-46. PMID: 1352289.
- ↑ Ramsey AJ, Fitzpatrick PF; Fitzpatrick, PF «Effects of phosphorylation of serine 40 of tyrosine hydroxylase on binding of catecholamines: evidence for a novel regulatory mechanism.». Biochemistry, 37, 25, 23-06-1998, pàg. 8980-6. DOI: 10.1021/bi980582l. PMID: 9636040.
- ↑ Wang, Shanzhi; Sura, Giri R.; Dangott, Lawrence J.; Fitzpatrick, Paul F. «Identification by hydrogen/deuterium exchange of structural changes in tyrosine hydroxylase associated with regulation». Biochemistry, 48, 22, 09-06-2009, pàg. 4972–4979. DOI: 10.1021/bi9004254. ISSN: 1520-4995. PMC: PMC2730116. PMID: 19371093.
- ↑ Gordon SL, Webb JK, Shehadeh J, Dunkley PR, Dickson PW; Webb, JK; Shehadeh, J; Dunkley, PR; Dickson, PW «The low affinity dopamine binding site on tyrosine hydroxylase: the role of the N-terminus and in situ regulation of enzyme activity.». Neurochemical research, 34, 10, octubre 2009, pàg. 1830-7. DOI: 10.1007/s11064-009-9989-5. PMID: 19448984.
- ↑ Dewing P, Chiang CW, Sinchak K, Sim H, Fernagut PO, Kelly S, Chesselet MF, Micevych PE, Albrecht KH, Harley VR, Vilain E; Chiang, CW; Sinchak, K; Sim, H; Fernagut, PO; Kelly, S; Chesselet, MF; Micevych, PE; Albrecht, KH; Harley, VR; Vilain, E «Direct regulation of adult brain function by the male-specific factor SRY.». Current biology : CB, 16, 4, 21-02-2006, pàg. 415-20. DOI: :10.1016/j.cub.2006.01.017. PMID: 16488877.
- ↑ 35,0 35,1 Bobrovskaya L, Gilligan C, Bolster EK, Flaherty JJ, Dickson PW, Dunkley PR; Gilligan, C; Bolster, EK; Flaherty, JJ; Dickson, PW; Dunkley, PR «Sustained phosphorylation of tyrosine hydroxylase at serine 40: a novel mechanism for maintenance of catecholamine synthesis.». Journal of neurochemistry, 100, 2, gener 2007, pàg. 479-89. DOI: 10.1111/j.1471-4159.2006.04213.x. PMID: 17064352.
- ↑ Janenaite, Egle; Vengeliene, Valentina; Bespalov, Anton; Behl, Berthold «Potential role of tyrosine hydroxylase in the loss of psychostimulant effect of amphetamine under conditions of impaired dopamine transporter activity». Behavioural Brain Research, 334, 15-09-2017, pàg. 105–108. DOI: 10.1016/j.bbr.2017.07.028. ISSN: 1872-7549. PMID: 28750831.
- ↑ Pearl, Phillip L.; Taylor, Jacob L.; Trzcinski, Stacey; Sokohl, Alex «The pediatric neurotransmitter disorders». Journal of Child Neurology, 22, 5, maig 2007, pàg. 606–616. DOI: 10.1177/0883073807302619. ISSN: 0883-0738. PMID: 17690069.
- ↑ Reference, Genetics Home. «dopa-responsive dystonia» (en anglès). [Consulta: 26 octubre 2017].
- ↑ Goodwill, K. E.; Sabatier, C.; Marks, C.; Raag, R.; Fitzpatrick, P. F. «Crystal structure of tyrosine hydroxylase at 2.3 A and its implications for inherited neurodegenerative diseases». Nature Structural Biology, 4, 7, juliol 1997, pàg. 578–585. ISSN: 1072-8368. PMID: 9228951.
- ↑ Thibaut, F.; Ribeyre, J. M.; Dourmap, N.; Meloni, R.; Laurent, C. «Association of DNA polymorphism in the first intron of the tyrosine hydroxylase gene with disturbances of the catecholaminergic system in schizophrenia». Schizophrenia Research, 23, 3, 28-02-1997, pàg. 259–264. ISSN: 0920-9964. PMID: 9075305.
- ↑ Hedstrand, H.; Ekwall, O.; Haavik, J.; Landgren, E.; Betterle, C. «Identification of tyrosine hydroxylase as an autoantigen in autoimmune polyendocrine syndrome type I». Biochemical and Biophysical Research Communications, 267, 1, 07-01-2000, pàg. 456–461. DOI: 10.1006/bbrc.1999.1945. ISSN: 0006-291X. PMID: 10623641.
- ↑ Jung, Hyo Young; Kim, Dae Won; Nam, Sung Min; Kim, Jong Whi; Chung, Jin Young «Pyridoxine improves hippocampal cognitive function via increases of serotonin turnover and tyrosine hydroxylase, and its association with CB1 cannabinoid receptor-interacting protein and the CB1 cannabinoid receptor pathway». Biochimica Et Biophysica Acta, 19-09-2017. DOI: 10.1016/j.bbagen.2017.09.006. ISSN: 0006-3002. PMID: 28935605.
- ↑ Lee, Young-A.; Goto, Yukiori «Chronic stress effects on working memory: association with prefrontal cortical tyrosine hydroxylase». Behavioural Brain Research, 286, 01-06-2015, pàg. 122–127. DOI: 10.1016/j.bbr.2015.03.007. ISSN: 1872-7549. PMID: 25746453.
- ↑ Stamelou, Maria; Mencacci, Niccolo E.; Cordivari, Carla; Batla, Amit; Wood, Nick W. «Myoclonus-dystonia syndrome due to tyrosine hydroxylase deficiency». Neurology, 79, 5, 31-07-2012, pàg. 435–441. DOI: 10.1212/WNL.0b013e318261714a. ISSN: 0028-3878. PMC: PMC3405253. PMID: 22815559.
- ↑ Reference, Genetics Home. «myoclonus-dystonia» (en anglès). [Consulta: 26 octubre 2017].
- ↑ Ono, Masaji; Okamoto, Masaru; Kawabe, Norio; Umezawa, Hamao; Takeuchi, Tomio «Oudenone, a novel tyrosine hydroxylase inhibitor from microbial origin». Journal of the American Chemical Society, 93, 5, 01-03-1971, pàg. 1285–1286. DOI: 10.1021/ja00734a054. ISSN: 0002-7863.
- ↑ Ayukawa, S.; Takeuchi, T.; Sezaki, M.; Hara, T.; Umezawa, H. «Inhibition of tyrosine hydroxylase by aquayamycin». The Journal of Antibiotics, 21, 5, maig 1968, pàg. 350–353. ISSN: 0021-8820. PMID: 5726288.