Homeòstasi del fosfat
| Aquesta pàgina o secció és sospitosa de no respectar la neutralitat del punt de vista. |
L'homeòstasi del fosfat és l'equilibri i l'estabilitat interns dels grups fosfat en els diferents organismes i sistemes biològics.
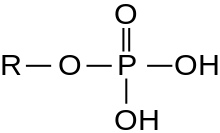
En les regions extracel·lulars a prop de la membrana plasmàtica, porcions de molècules associades a la membrana, esperen capturar fosfat i transportar-lo a l'interior de la cèl·lula. El fosfat es pot produir com partícules d'ortofosfat inorgàniques o ser part d'una molècula orgànica(organofosfat). Aportar fosfat de qualsevol manera a l'interior de la cèl·lula i, quan sigui necessari, transportar fosfat a l'exterior, és una activitat necessària per a l'homeòstasi fosfat[1] de la cèl·lula.
Degut a la seva alta reactivitat, el fòsfor no es troba mai com un element lliure a la natura. Els fosfats es troben omnipresents en la biologia. El fosfat és un component de l'àcid desoxiribonucleic i de l'ARN i un element essencial per a totes les cèl·lules vives. El metabolisme de fosfat és el conjunt complet de reaccions químiques amb fosfat i es dona a les cèl·lules vives. El fòsfor (com fosfat normalment) sovint és un nutrient limitant en alguns ambients; per exemple, la disponibilitat de fòsfor regula la taxa de creixement de molts organismes. Les cèl·lules vives també utilitzen fosfat pel transport d'energia cel·lular a través d'adenosina trifosfat(ATP). Quasi tots els processos cel·lulars que utilitzen energia l'obtenen en forma d'ATP. Dintre de la cèl·lula, el fosfat pot ser l'estructura d'un àcid nucleic o de fosfolípids, formant enllaços èster d'alta energia (per exemple, en el trifosfat d'adenosina), o participar en la senyalització. En l'exterior de la cèl·lula, el fosfat pot estar dissolt en el líquid extracel·lular o format estructures com ossos i dents. En medicina, els símptomes de baix fosfat són causats per malnutrició, falta d'absorció de fosfat, i per síndromes metabòlics que extreuen fosfat de la sang o en passen massa a l'orina. Tots són caracteritzats per la hipofosfatèmia. Els símptomes de baix fosfat inclouen disfuncions musculars i neurològiques, i l'alteració dels músculs i de les cèl·lules sanguínies a causa de la falta d'ATP.
En els ecosistemes, un excés de fòsfor pot ser problemàtic, especialment en sistemes aquàtics on l'excés pot (l'eutrofització i la proliferació d'algues.)
Aportar fosfat en qualsevol forma a l'interior de la cèl·lula i quan és necessari, transportar el fosfat a l'exterior de la cèl·lula és una activitat necessària per a l'homeòstasi fosfat de la cèl·lula. Un organisme que pot regular el seu medi intern per tal de mantenir l'equilibri té la propietat de l'homeòstasi. L'ATP és important per la fosforilació, un esdeveniment clau en les cèl·lules.
Homeòstasi modifica
L'homeòstasi és un estat relativament estable d'equilibri o d'una tendència cap a un estat així d'un sistema obert o tancat, especialment en un organisme viu. Un organisme que pot regular el seu medi intern per tal de mantenir l'equilibri té la propietat de l'homeòstasi.
Fosfat modifica
El fosfat es pot produir com una sal d'àcid fosfòric o un ester àcid(un organofosfat). Els fosfats es troben omnipresents en la biologia. El fòsfor (com fosfat normalment) és un macro mineral per les plantes, el qual és estudiat àmpliament en la conservació del terra per tal de comprendre el sistema d'absorció de les plantes del terra. En termes ecològics, el fòsfor és sovint un nutrient limitant en diversos medis;per exemple, la disponibilitat del fòsfor regula la taxa de creixement de molts organismes. En els ecosistemes, un excés de fòsfor pot ser problemàtic, especialment en els sistemes aquàtics.
Dintre de la cèl·lula, el fosfat pot ser l'estructura d'un àcid nucleic o de fosfolípids, formar enllaços èster d'alta energia (per exemple, en el trifosfat d'adenosina), o participar en la senyalització cel·lular.
En l'exterior de la cèl·lula, el fosfat pot estar dissolt en el líquid extracel·lular o formant estructures com ossos i dents. Pels éssers humans el fosfat és vida. Sense ell no podríem pensar, no podríem sentir ni tampoc moure'ns.
Metabolisme del fosfat modifica
Respecte a la sèrie completa de reaccions químiques de fosfat en les cèl·lules vives, hi ha aproximadament 2371 reaccions.[2] De fet, en relació amb el polifosfat hi ha aproximadament 10 d'aquestes reaccions.[3]
En el metabolisme de la pirimidina, EC 3.6.1.2 (trimetafosfatasa) pot convertir trimetafosfat en trifosfat a través de la reacció: Trimetafosfat + H₂O ⇔ trifosfat (això porta a la producció de 2'-deoxi-5-hidroxi-metilcitidina-5'-trifosfat).[4]
L'activitat de la trimetafosfatasa ha estat trobada localitzada en el testicle de la rata durant la formació acrosomal.[5] Els osteoclasts secreten cap a les superfícies de resorció òssia.[6]
Fosforilació modifica
L'addició d'un grup fosfat (PO₄) a una altra molècula, incloses les proteïnes, és la fosforilació. Molts enzims i receptors són activats i desactivats per la fosforilació. La fosforilació està catalitzada per proteïna-cinases específiques. La desfosforilació està catalitzada per les fosfatases. La fosforilació d'un aminoàcid amb un grup hidroxil lliure en una proteïna donada pot canviar la funció, l'associació, o la localització d'aquesta.
La fosforilació oxidativa és el procés d'oxidació de nutrients per produir adenosina trifosfat (ATP). La fosforilació de substrats forma ATP per la transferència directa d'un grup fosfat a l'adenosina difosfat (ADP) des d'un intermediari reactiu. La fotofosforilació utilitza energia solar per sintetitzar ATP.
La fosforilació de sucres permet a les cèl·lules acumular sucres perquè el grup fosfat impedeixi que les molècules es difonguin un altre cop cap al seu transportista.
Bioenergètica de fosfat modifica
La bioenergètica implica el flux d'energia a través dels sistemes vius. Aquesta àrea de la investigació biològica inclou l'estudi dels processos cel·lulars com la respiració cel·lular que pot conduir a la producció i utilització d'energia en formes com la de molècules d'ATP. Les cèl·lules vives utilitzen el fosfat com a transport d'energia cel·lular a través dels nucleòtids com l'adenosina trifosfat (ATP. Quasi tots els processos cel·lulars que utilitzen energia l'obtenen en forma d'ATP.
Els protons en les solucions aquoses funcionen, en la producció d'ATP en les cèl·lules, com un mitocondri.[7] Altres fonts cel·lulars d'ATP (com la glucòlisi per l'acoblament directe de l'activitat enzimàtica per la producció d'ATP) no són la major font d'energia química útil en la majoria de les cèl·lules. L'acoblament quimiosmòtic és el major procés productor d'energia en moltes cèl·lules, que s'utilitzen en els cloroplasts i en molts organismes unicel·lulars, a més del mitocondri.
Fosfats catalítics modifica
Un fosfat que afecta a l'activitat catalítica d'un enzim és un fosfat catalític.[8] Ocasionalment, un enzim conté un fosfat estructural i un fosfat catalític.[8]
El fosfat γ de l'ATP és el fosfat catalític.
Els fosfats catalítics són àcid-làbil i base estable. Els fosfats estructurals són àcids estables, base “labile” .[9]
Fosfats estructurals modifica
Dintre de la cèl·lula, el fosfat pot ser l'estructura d'un àcid nucleic com l'àcid desoxiribonucleic o l'ARN o de fosfolípids. A l'exterior de la cèl·lula, el fosfat pot estar dissolt en el líquid extracel·lular o formant estructures com ossos i dents. Aportar fosfat en qualsevol forma a l'interior de la cèl·lula des d'una estructura que conté fosfat a una altra estructura, i quan sigui necessari transportar fosfat a l'exterior de la cèl·lula, potser cap a una altra estructura, és una activitat necessària per a l'homeòstasi fosfat de la cèl·lula.
Senyalització modifica
La senyalització de lípids implica al parell de receptors de les G-proteïnes als que l'àcid lisofosfàtidic (LPA) s'uneix, i a través del qual l'esfingosina-1-fosfat (S1P) actua, i el factor activador de les plaquetes (PAF), senyalitza. L'esdeveniment més important de la senyalització del diacilglicerol (DAG) és la hidròlisi del fosfatidilinositol (4,5)-bifosfat (PIP2) a DAG i a inositol trifosfat (IP3). IP3 és soluble i difon lliurement en el citoplasma. Pot ser reconegut pel trifosfat inositol receptor (IP3R). IP3 contribueix a l'activació de la proteïna-cinasa C (PKC).[10][11]
Fluid extracel·lular (ECF) modifica
El fluid extracel·lular normalment denota tots els fluids del cos fora de les cèl·lules. Freqüentment està contingut a l'interior dels òrgans. La pell, per exemple, és l'òrgan conegut com l'òrgan més gran del cos humà, ja que cobreix el cos, i sembla que té l'àrea de major superfície de tots els òrgans. Però és un gran contenidor de ECF i d'altres òrgans. ECF inclou el fluid intersticial (ISF) i el fluid tanscel·lular (TCF).
Els sistemes cardiovasculars són normalment tancats, el que significa que la sang mai surt de la xarxa de vasos sanguinis. En contrast, l'oxigen i els nutrients difonen a través de les capes dels vasos sanguinis i entren en el fluid intersticial (ISF), que transporta oxigen i nutrients a les cèl·lules, i diòxid de carboni i restes en la direcció oposada. També, els sistema digestiu, el qual conté TCF, treballa amb el sistema cardiovascular per proporcionar els nutrients que necessita el sistema per mantenir el batec del cor.
Fosfatidat modifica
L'àcid lisofosfatídic (LPA) és un intermediari en la síntesi de l'àcid fosfatídic (PA). ENPP2 funciona com una fosfolipasa que catalitza la transformació de la lisofosfatidilcolina en LPA en el ECF.[12] LPA ha estat detectat en el plasma, el líquid escític, en el líquid fol·licular i en l'humor aquós.[12]
ECF ortofosfat (Pi) modifica
El nivell d'ortofosfat inorgànic (Pi) està ben equilibrat a l'interior de la cèl·lula i en l'organisme vertebrat.[13] La concentració de fosfat lliure està equilibrada en el rang de milimolar en el ICF i ECF.[13] Els bacteris, llevats, plantes i vertebrats han desenvolupat les seves pròpies estratègies pel control de l'homeòstasi del Pi.[13] La necessitat diària de Pi està coberta per l'absorció intestinal de la dieta, el compartiment principal d'emmagatzemament és l'os, i la necessitat del metabolisme i de l'estructura intracel·lular, es compleix en part pels cotransportadors de fosfat.[13] La concentració de Pi en el ECF està fortament controlada per la regulació de l'excreció renal.[13] Les principals propietats de la reabsorció renal del Pi dels mamífers són la ph-dependència, la regulació per l'hormona paratiroide (PTH), i la disponibilitat del Pi.[13] Aquestes propietats s'expressen pel SLC34A1-3(transportador de fosfat, sodi-dependent 2, NPT2), mentre que el NPT3 (SLC17A2) intervé en el transport de Pi Na+-dependent.[13]
El NPT1 (SLC17A1) no té un paper destacat en la regulació de l'homeòstasi Pi del cos.[13] La insulina estimula l'expressió del NPT1 i la captació del Na+/Pi que s'inverteix pel “glucagon”.[13] El NPT3 pot tenir un paper de neteja a nivell cel·lular per la seva àmplia gamma d'expressió i la seva capacitat per adaptar-se als canvis en la concentració extracel·lular de Pi.[13] L'expressió de NPT3 és compatible amb la presència d'altres TNP.[13] Els membres de la família NPT1 estan vinculats amb el metabolisme de glucosa que estimula la insulina.[13] El NPT2 en el ronyó i en l'intestí prim són responsables de l'acumulació intracel·lular de Pi per tal d'establir un flux de Pi transepitalial.[13] El NPT4 (SLC17A3) s'expressa en l'intestí prim, en el ronyó, en el fetge i en els testicles.[14]
ECF pirofosfat (PPi) modifica
PPi es produeix en el líquid sinovial, el plasma i l'orina en nivells suficients per bloquejar la calcificació i pot ser un inhibidor natural de la formació d'hidoxiapatia en el ECF.[15]
Sang modifica
La sang és un ECF especialitzat del cos que està continguda en el sistema cardiovascular que està compost de glòbuls suspesos en el plasma. El seu contingut de fosfat està de diverses formes. La llista de components de la sang humana és: adenosina trifosfat (ATP), la seva concentració en sang és de 3,1-5,7 x 10-4 g/cm³, que és l'equivalent de 5-10 x 10-5 g/cm³ de fòsfor; difosfoglicerat és de 8-16 x 10-5 g/cm³; cGMP és 0,6-4,4 x 10-9 g/cm³; hexosafosfat P és 1.4-5 x 10-5 g/cm³ (0-2 x 10-6 g/cm³ en el plasma o sèrum); l'àcid desoxiribonucleic està entre 0-1,6 x 10-5 g/cm³ en el plasma o en el sèrum; el fosfolípid està entre 2,25-2,85 x 10-3 g/cm³ (5-12 x 10-5 g/cm³ en el plasma o en el sèrum); el nucleòtid de pirimidina està entra 2,6-4,6 x 10-5 g/cm³ (2-12 x 10-7 g/cm³ en el plasma o en el sèrum); i ARN està entre 5-8 x 10-4 g/cm³ (4-6 x 10-5 g/cm³ en el plasma o en el sèrum). El Pi es produeix en la sang, plasma sanguini i sèrum sanguini.[16] El contingut de fòsfor total és de 3,5-4,3 x 10-4 g/cm³ (2,3-4,5 x 10-5 g/cm³ i 1-1,5 x 10-4 g/cm³ en el plasma o en el sèrum, respectivament).
Ortofosfat sanguini modifica
Un lleuger augment en el pH del plasma sanguini per sobre de 7,4 causa la precipitació de fosfat de calci i la resultant “turbidesa”, mentre que, en el cas del sèrum de la sang (plasma sense proteïnes de coagulació) de la mateixa composició inorgànica, el pH pot variar de manera bastant àmplia, sense que passin coagulacions.[16]
Es tracta de les proteïnes que tendeixen a mantenir les sals de calci en solució o com a mínim en suspensió.[16] El sèrum de la sang està sobresaturat amb fosfat tricalcic de al voltant d'un pH de 6,8 fins a un pH d'aproximadament 9,25, amb una dissolució màxima a pH 7,3.[16] L'estabilitat del fosfat de calci en suspensió pot ser millorada per la reducció de l'ió fosfat en proporció al calci en la mescla. Amb l'augment d'alcalinitat per sobre de pH 6,3 el fosfat es converteix en fosfat dicalcic. En un pH de 6,7 el tricalcium fosfat es comença a formar mentre encara roman en suspensió en la presència de proteïnes.
Els ions hidroxil i les proteïnes tenen efectes antagònics sobre la suspensió de fosfat tricalcic per tal que amb l'increment d'alcalinitat la mida de la suspensió depengui de la concentració de proteïna. L'increment de la concentració de sèrum disminueix la “turbidesa”. La proteïna exerceix un efecte inhibitori en la precipitació del fosfat de calci subjectant-lo en una solució contra algun altre factor físic i mitjançant la suspensió.[16]
Pirofosfat sanguini modifica
Els nivells de plasma sanguini de PPi en un nen normal humà pot variar aproximadament entre 300-700 pmol/ µg de proteína.[17]
Entrada de fosfat modifica
Portar el fosfat en qualsevol forma a l'interior de la cèl·lula, possiblement d'una estructura que contingui fosfat, per a una altra estructura d'aquest tipus, podrà requerir la fagocitosis, l'endocitosi, o una proteïna que importi fosfat o simporter.
L'EC 3.6.3.20 és un enzim importador de fosfat que catalitza la reacció química: ATP + H₂O + glicerol-3-fosfatat ⇔ ADP + fosfat + glicerol-3-fosfateina.
L'EC 3.6.3.27 és un enzim importador de fosfat que catalitza la reacció química: ATP + H₂O+ phosphateout ⇔ ADP + phosphate + phosphatein.
Entrada d'ortofosfat modifica
L'hormona de creixement, com a mínim regulada pel factor I de creixement de la insulina (IGF-I), estimula el cotransport de Pi.[18] L'hormona tiroidea estimula l'absorció de Pi a través d'un augment específic en el cotransport de Pi.[18] Stanniocalcin 1 (STC1) stimulates membrane Pi cotransport.[18] Stanniocalcin 1 (STC1) estimula el cotransport de Pi en la membrana.
Els factors de Fosfaturic redueixen l'expressió dels transportadors de Pi o cotranportadors en la membrana cel·lular.[19]
La insulina millora l'absorció de Pi estimulant el cotransport de Pi i prevenint de l'acció del fosfaturic sobre l'hormona paratiroide(PTH).[18] La calcitonina redueix el cotransport de Pi en la membrana en una PTH- i AMPc- de manera independent.[18]
Alguns factors que augmenten l'absorció de Pi incrementen el nombre de transportadors o cotransportadors en la membrana cel·lular.[19] El coneixement dels mecanismes que controlen l'expressió del transportador i recuperació de la membrana són essencials per entendre com s'aconsegueix l'homeòstasi de Pi.
La regulació fisiològica del Pi implica, en el que s'ha estudiat a nivell molecular, una expressió alterada de la proteïna contransportadora que es relaciona en la majoria de casos amb la velocitat màxima (Vmax) de la velocitat del contransportador de Pi.[18]
ISF, absorció del Pi modifica
PiT1 és probable que sigui un portador important de fosfat a ISF en la majoria de tipus de cèl·lules.[20] La Vmax pot anar aproximadament de 39 a 121, amb ISF fosfat al ISF del fosfat lliure.[20] El nivell de fosfat de les cèl·lules mamàries (75 miliequivalents per litre) es mantenen a nivells superiors a la ISF (4 miliequivalents per litre) en oposició a un gradient electroquímic que afavoreix el “phosphateout”.[20]
Uns nivells baixos de Pi en la ECF poden resultar d'una regulació de Pit1 i de l'expressió de Pit2 en cèl·lules mamàries.[21] Pit1 i Pit2 mostren una cooperació positiva en la captació de Pi. Pit2 dona suport a la captació de Pi Na+-independent.[21] El Ca2+ o Ca2+ i Mg2+ augmenten Pit1- i Pit2- regulant l'import de NaPi.[21] La Vmax pel Pit1 i el Pit2 és aproximadament 453 i 450 pmol·cèl·lula-1·h-1 respectivament.[21] El consum mitjà de Pi en Pit1 i Pit2 a un pH de 7,5 és d'aproximadament 118 i 115 pmol·cèl·lula-1·h-1 respectivament.[21] El transport de Pi té una mitjana de captació similar en els diferents valors de pH: 5,5 a 8,5.[21] El captador de Pi Na+-independent de Pit2 està en condicions del ECF àcides.[21] Amb la concentració fisiològica del Na+ en el cos humà en el rang de 130-145 mM, sempre està ple per mantenir la via de captació a través de Pit1 i Pit2[21]
Petites absorcions intestinals de Pi modifica
El consum d'una dieta baixa en fosfat inorgànic (Pi) pot conduir a una absorció de quasi el 100% de Pi filtrat, mentre que en una ingestió dietètica alta de Pi condueix a una disminució de l'absorció de Pi.[18] Aquests canvis poden succeir independentment dels canvis en la concentració d'ECF de les diferents hormones fofaturiques.[18]
En la part superior de l'intestí prim, la Vitamina D₃] estimula el cotransport de Pi.<[18] La fosfoglicoproteïna de la matriu extracel·lular (MEPE), una fosfatonina, promou la fosfatúria.[22] El “short-term infusion of MEPE" inhibeix l'absorció de fosfat en el jejú però no en el duodè.[22] L'efecte a curt termini del MEPE en el maneig dels fosfat renal o intestinal passa sense cap canvi en els nivells que circulen de l'hormona paratiroidea (PTH), 1,25- dihidroxivitaminaD3, o el factor de creixement de fibroplasts 23 (FGF23).[22] La MEPE potser participa en l'homeòstasi de fosfat, actuant en el ronyó i en el tractat gastrointestinal.[22]
Hi ha evidència d'una hormona/ enzim/ proteïna de la matriu extracel·lular en cascada involucrada amb el factor de creixement dels fibroplasts 23 (FGF23), el fosfat lligat al cromosoma X que regula l'homòleg endopeptidasa (PHEX), i a la fosfocligoproteïna de la matriu extracel·lular (MEPE) que regula el sistema de l'homeòstasi de fosfat i la mineralització.[23]
Reabsorció renal de Pi modifica
L'NPT2 domina en la reabsorció renal del Pi, que és exclusiu sota condicions no patològiques al ronyó dels mamífers.[13] El sodi (Na+) interacciona de forma cooperativa amb l'NPT2 amb una estequiometria de 3Na+, 1Pi .[13] Els protons (H+) disminueixen l'afinitat del NPT2 pel Na+.[13]
Existeix un vincle entre l'acció de l'hormona paratiroidal (PTH), la disponibilitat del fosfat, i la integració/recuperació de NPT2 a la membrana de la cèl·lula renal.[13] Els canvis en el contingut de Pi a la dieta tenen un efecte regulador en la reabsorció del Pi.[24] La restricció de Pi en la dieta s'associa a un increment adaptatiu de la capacitat global de captació de Pi intervinguda per un augment de la Vmax del transport de fosfat dependent del gradient de sodi.[24] En resposta a una restricció crònica (8 dies) del fosfat a la dieta, l'increment adaptatiu en l'activitat de cotransport de sodi-Pi s'associa amb els increments paral·lels de NPT2 i de l'abundància del seu ARNm.[24] No obstant això, en resposta a una restricció aguda (2h) del fosfat a la dieta, el ràpid increment adaptatiu en l'activitat de cotransport de sodi-Pi s'associa a augments paral·lels de NPT2, però sense canvi en l'abundància del seu ARNm.[24]
El paper del NPT2 intracel·lular en la ràpida adaptació a la dieta de Pi està relacionat amb la localització de la proteïna 58 kDa de la membrana de Golgi i la glicoproteïna Igp120 de la membrana lisosomal, de la següent manera: després de l'adaptació crònica a una dieta rica en Pi, NPT2 està a la regió de la membrana subcel·lular i a la regió perinuclear que, en part, coincideix espacialment amb el compartiment de Golgi però no amb el compartiment lisosomal. L'adaptació aguda d'una dieta rica en Pi a una dieta pobra en Pi fa que hi hagi un esgotament de NPT2 intrecel·lular, estant només el NPT2 al compartiment de Golgi. Després de l'adaptació crònica a una dieta pobra en Pi, l'NPT2 es localitza predominantment a la regió del compartiment de Golgi i addicional de la membrana subcel·lular i regions centrals de la cèl·lula, amb una localització mínima a la Igp120. L'adaptació aguda d'una dieta pobra en Pi a una dieta rica en Pi fa que hi hagi un augment en l'abundància de NPT2 intracel·lular a la membrana subcel·lular i regions centrals, amb una considerable localització al compartiment lisosomal.
La resposta crònica adaptativa a una dieta pobra en Pi es caracteritza per un augment en l'abundància de ARNm del NPT2.[24]
El paper dels microtúbuls modifica
En la probable ràpida [translocació] del NPT2 en resposta a una administració aguda d'una dieta pobra en Pi, els microtúbuls (tubulina) estan involucrats en la regulació positiva de l'activitat del NPT2 i la translocació des de compartiments intracel·lulars a les proximitats del nucli cel·lular fins a la membrana cel·lular, però no estan involucrats en l'expressió de NPT2.[24] Quant a la resposta a una administració aguda d'una dieta rica en Pi després de l'administració crònica d'una dieta pobra en Pi, els microtúbuls no estan involucrats en la ràpida regulació negativa de l'activitat NPT2 o l'abundància de NPT2.[24] El ràpid increment adaptatiu en el NPT2 de la membrana subcel·lular amb una alimentació crònica d'una dieta rica en Pi, després d'una administració aguda d'una dieta pobra en Pi, probablement és intervinguda per la translocació de NPT2 presintetitzat a aquesta regió per mecanismes dependents dels microtúbuls.[24] L'orientació del NPT2 a la membrana cel·lular sembla dependre de la xarxa de microtúbuls.[24]
El paper dels microfilaments modifica
Els microfilaments (citoesquelet d'actina) possiblement té un paper central en la ràpida regulació negativa del cotransport Na+-Pi.[24] S'ha demostrat la dependència de l'endocitosi en els microfilaments intactes en cèl·lules epitelials polaritzades.[24]
Entrada de l'organofosfat modifica
Les fosfatases d'àcid fosfatídic (PAPs) transporten àcid fosfatídic (PA), àcid lisofosfatídic (LPA), ceramida 1-fosfat (C1P) i esfingosina 1-fosfat (S1P) des de ECF a través de la membrana plasmàtica a diferents Vmax.[25] Un cop dins la cèl·lula, aquestes PAPs (PPAP2A, PPAP2B i PPAP2C) hidrolitzen cada fosfat per EC 3.1.3.4:
un 3-sn-fosfatidat + H2O ⇔ un 1,2-diacil-sn-glicerol + Pi.
PPAP2A mostra uns valors comparables de Vmax per als quatre substrats, amb una activitat més elevada per LPA i PA. PPAP2B mostra, d'igual manera, una Vmax d'activitat més alta amb LPA, mentre que PPAP2C mostra una activitat significativament major amb S1P.[25] Per a algunes cèl·lules, el PPAP2A pot ser un ectoenzim que desfosforila PA a la forma de diacilglicerol (DG) abans del transport del DG cap a la cèl·lula.[25]
Intercanvi de fosfat modifica
El transportador del glicerol fosfat (GlpT) transporta glicerol-3-fosfat (G3P) cap al citoplasma i el Pi cap al periplasma.[26] Encara que el GlpT transporta entre els compartiments cel·lulars a través de les membranes internes, també pot transportar a través de la membrana cel·lular.[27] GlpT funciona per a G3P i és impulsat per un gradient electroquímic de Pi. L'alliberació periplasmàtica (o ISF) de Pi permet el seu reemplaçament pel G3P, que té major afinitat, al centre d'unió del substrat; a la cara citoplasmàtica de la membrana, el Pi reemplaça al G3P a causa de la major concentració citosòlica.[26]
Sortida del fosfat modifica
Sortida de l'ortofosfat modifica
En condicions d'estat fisiològic normal o d'equilibri, l'excreció urinària del Pi correspon aproximadament a la ingesta de fosfat al tracte gastrointestinal, principalment a través de l'intestí prim.[18] Per complir amb l'homeòstasi del fosfat, és a dir, mantenint la concentració extracel·lular de Pi dins d'un rang estret, l'excreció urinària del Pi ha d'estar sota un estricte control fisiològic.[18] En contrast amb l'absorció intestinal de Pi, que s'ajusta bastant lenta, l'excreció renal de Pi es pot ajustar molt ràpidament als canvis en les condicions fisiològiques.[18] En concret, el contingut proteic del cotransport del Pi a la membrana, i per tant l'absorció de Pi, respon dins dels horaris a les alteracions en la ingesta dietètica de Pi.[18] L'hormona paratiroidal (PTH) indueix la fosfatúria per inhibició de l'activitat de cotransport de Pi.[18] Els glucocorticoides augmenten l'excreció de fosfat per una inhibició del cotranport de Pi a la membrana, independentment d'un augment de PTH.[18] Stanniocalcina 2 (STC2) pot suprimir el cotransport de Pi.[18]
Sortida del pirofosfat modifica
Les cèl·lules poden canalitzar el PPi intracel·lular cap a ECF.[17] ANK és un canal de PPi no enzimàtic i plasmamembranós que manté els nivells extracel·lulars de PPi. La funció defectuosa del canal de PPi de la membrana ANK està associada a baixa concentració extracel·lular de PPi i a alta concentració intracel·lular de PPi.[15] L'ectonucleòtid pirofosfatasa/fosfodiesterasa (ENPP) pot actuar per incrementar la concentració extracel·lular de PPi.[17]
Reserves de fosfat modifica
Un adult ben alimentat en el món industrialitzat consumeix i excreta entre 1-3g de fòsfor al dia en forma de fosfat (2-6 x 1022 molècules). Per la composició elemental de “l'home estàndard” de 70kg, el fòsfor correspon a 780g o 1,1% (com 1.52 x 1025 molècules de fosfat).[28] D'aquest 1.4g/kg (98 g, 1.9x1024 molècules de fosfat) estan presents en teixits tous i la resta (1.33 x 1025 molècules de fosfat) en teixits mineralitzats com els ossos i les dents.[29] Només un 0,1% del fosfat del cos (unes 2 x 1022 molècules) circula per la sang, però aquesta quantitat reflecteix la quantitat de fosfat disponible per a cèl·lules de teixits tous. El plasma sanguini conté ortofosfat (en forma de HPO₄2-) i H₂PO₄- en una proporció aproximada de 4:1.[29]
La quantitat total d'ATP al cos de l'humà és d'uns 0,1 mols (unes 6 x 1022 molècules). Aquest ATP és constantment desglossat a ADP, i després reconvertit a ATP. En qualsevol moment, la quantitat total de ATP+ADP és bastant constant. L'energia utilitzada per la cèl·lula humana necessita la hidròlisi d'entre 100 i 150 mols (6 a 9 x 1025molècules) d'ATP al dia, el que correspon a 50 o 75kg. Típicament, un humà utilitzaria fins al seu pes corporal d'ATP al llarg del dia. Això vol dir que cada molècula d'ATP es recicla de 1000 a 1500 vegades al dia, o aproximadament a cada minut. Les activitats de PPi-generació pirofosfohidrolasa nucleòsid trifosfat (EC 3.1.4.1) d'un grup d'ecto-enzims en la família de pirofosfatasa nucleòtid fosfodiesterasa (PDNP) han estat reconeguts a contribuir en la regulació dels nivells intracel·lulars i extracel·lulars de PPi en diversos teixits.[17]
Fosfat intracel·lular modifica
Tenint en compte que el nombre de cèl·lules al cos humà és de 10-100 trillons o 1013 a 10¹⁴, hi ha aproximadament 1.9-19.0 x 10¹⁰ àtoms de fòsfor (molècules de fosfat) per cèl·lula. El volum d'una cèl·lula típica és de 5 x 10-16 m³. Si una cèl·lula típica fos totalment aigua líquida, hi hauria unes 1.7 x 1013molècules d'aigua present. Llavors, la concentració de fosfat seria de l'ordre de 10-3. Tot i així, la cèl·lula és el doble de densa que l'aigua, llavors potser només el 50% de l'aigua, obtenint 5 x 10-3 per la concentració de fosfat. Com ha demostrat una simulació amb ordinador, la probabilitat de trobar un objectiu per difusió disminueix ràpidament amb la distància i esdevé <1% quan la distància sigui superior a 10 cops el radi de l'objectiu,[30] que suposant un volum esfèric simple posaria la concentració de l'objectiu a l'ordre de 5 x 10-3.
Encara que l'ectonucleòtid pirofosfatasa/fosfodiesterasa 3 (ENPP3) regula les concentracions de PPi intracel·lulars, no sembla que reguli significativament la concentració extracel·lular de PPi.[17]
Fosfat extracel·lular modifica
El PPi inhibeix la deposició de l'hidroxipatita als ossos i als cartílags.[17] Molts estudis han demostrat que el PPi és un potent inhibidor de la calcificació, la mineralització dels ossos i la resorció òssia.[15] Els defectes de la fosfatasa alcalina, un enzim que degrada el PPi, provoca un augment en els nivells del PPi i un bloqueig en la mineralització de l'esquelet.[15] Defectes genètics en els ectoenzims de la superfície cel·lular, que normalment genera PPi extracel·lular a partir de nucleòtid trifosfat, causa mineralització ectòpica de les articulacions i els lligaments, i pot estar relacionada amb l'ossificació del lligament espinal en humans.[15]
Ossos modifica
Durant la resorció òssia, són alliberats uns alts nivells de fosfat a ECF com túnels d'osteoclasts en l'os mineralitzat, descomponent-lo i alliberant fosfat, que resulta en una transferència de fosfat des del fluid ossi cap a la sang. Durant la infantesa, la formació òssia supera la resorció, però a mesura que s'avança en edat, la resorció supera la formació.
Regulació del fosfat modifica
L'organisme que pot regular el seu medi intern per tal de mantenir l'equilibri té la propietat d'homeòstasi. Aquelles proteïnes que estimulen l'entrada de fosfat o la sortida de fosfat, regulen la concentració de fosfat. Kinases proteiques específiques catalitzen la fosforilació mentre que les fosfatases catalitzen la desfosforilació. Aquestes kinases i fosfatases regulen la forma del fosfat i la disponibilitat del fosfat. L'ATP és important per la fosforilació, un esdeveniment clau en la regulació a les cèl·lules. El factor de creixement dels fibroblasts 23 (FGF23) és essencial pel manteniment de l'homeòstasi del fosfat. Cloto és integral dins la membrana plasmàtica[31] i essencial per la funció endògena del FGF23.[32] FGF23 regula l'NPT2a independent de l'hormona paratiroidal (PTH) i el sèrum de nivell 1,25-dihidroxivitamina D per control d'expressió renal d'enzims clau del metabolisme de la vitamina D.[33] FGF23 inhibeix el transport renal tubular del fosfat.[34] La secreció de FGF23 requereix O-glicosilació, que està dirigida específicament per GALNT3, per bloquejar el processament de FGF23.[35]
Tant NPT2 com NPT2c són regulats de forma similar per l'hormona paratiroidal (PTH), FGF23, i el fosfat de la dieta.[36] La privació del fosfat augmenta l'expressió de NPT2 i NPT2c.[36] L'expressió relativa de NPT2a és un ordre de magnitud més alt que la de NPTC2c en ronyons d'organismes que es mantenen en una dieta normal de fosfat.[36] Els animals normals mostren un creixement més robust del NPT2c que de NPT2a en resposta a la privació del fosfat.[36] NPT2c és regulat per FGF23 i probablement regulat negativament per PTH. SLC34A3 (NPT2c) contribueix al manteniment de la concentració de fosfat al ronyó.[37]
PHEX podria regular l'expressió de FGF23 com a part d'un eix potencial hormonal entre l'os i el ronyó que controla l'homeòstasi sistemàtica del fosfat i la mineralització.[38] PHEX està expressada altament als cartílags, als ossos, a les dents, on és present als osteoblasts, osteòcits i odontoblasts, especialment en la transició entre la maduració dels pre-osteoblasts i els osteoblasts madurs, quan l'expressió del PHEX està normalment regulada positivament.[38]
Transistasi del fosfat modifica
El poder o la tendència d'un ésser viu per anar canviant les seves necessitats de fosfat d'acord amb les transformacions de les circumstàncies, és transistasi de fosfat; és a dir, reformar les seves funcions per mantenir una condició significativa, per mitjà de múltiples ajustaments de l'equilibri dinàmics, controlat per mecanismes de regulació de fosfat interrelacionats. L'homeòstasi i la transistasi es necessiten per mantenir l'estabilitat i per sobreviure. Un organisme ha de suportar, adaptar, i evolucionar a les modificacions del medi. Fa això provant de quines maneres haurien de ser ajustades les seves variables, sent ultraflexible.
La retroalimentació negativa és una reacció en la qual el sistema respon de manera que s'inverteixi la direcció del canvi. Com que això tendeix a mantenir les coses constants, permet el manteniment de l'homeòstasi.
En la retroalimentació positiva, la resposta és amplificar el canvi en la variable, permeten el manteniment de la transistasi.
Creixement de la cèl·lula i limitació del fosfat modifica
El model matemàtic de la cinètica de taxes del creixement i de la formació de la fosfatasa àcida, sota diversos graus de limitació de fosfat es refereix a (a) el temps de creixement exponencial, (b) el creixement bifàsic del substrat (glucosa) i el seu producte, (c) un creixement sostingut en fosfat conservatiu, i (d) la desrepressió de la fosfatasa àcida. Els càlculs numèrics usant constats paramètriques apropiades, descriuen la variació de massa, glucosa, producte i concentració de fosfat inorgànic a les cèl·lules, i l'activitat enzimàtica de la fosfatasa àcida durant el creixement aeròbic sota diferents condicions de necessitat de fosfat. Un estudi de simulació va revelar que la concentració inicial òptima de fosfat per donar una alta productivitat d'àcid fosfat és de 2.0mg fòsfor/g litre glucosa.[39]
Regulació dels transportadors de fosfat modifica
La regulació dels transportadors de fosfat mitjançant les vies de senyalització de resposta a nutrients permet a les cèl·lules adaptar la disponibilitat del fosfat a les condicions del medi.[40] Les cèl·lules amb falta de fosfats activen circuits de feedback, ja sigui positiu o negatiu, en una interacció que porta a una biestabilitat en l'ús del transportador del fosfat.[40] El feedback positiu pot ser generat per un inhibidor amb poca afinitat pel fosfat, on algunes de les cèl·lules expressen una afinitat, ja sigui gran o petita, amb els transportadors i els dos poden tenir una capacitat d'absorció del fosfat similar.[40]
Pressupost del fosfat modifica
La quantitat de fosfat necessitat o disponible per a un propòsit, incloent estimacions del fosfat que entra i del fosfat que surt, i la forma del fosfat, determina el pressupost del fosfat per a una cèl·lula o un organisme enter.
Un pressupost dinàmic del fosfat es pot modelar determinant les relacions entre el carregament extern del fosfat, reciclant amb la formació de fosfats estructurals, i la productivitat que resulta, que són complicades pels mecanismes de la regeneració, les variacions periòdiques i les tendències.[41] En un model dinàmic del pressupost del fosfato les variables inclouen el fosfat de partícules inorgànic i orgànic i el fosfat dissolt, en fosfat estructural i nucleosol. El fosfat estructural pot ser aeròbic o anaeròbic, depenent de la localització, de la temperatura (o del pH) i de la composició. Els processos que millor es poden descriure són producció, mineralització, precipitació, adsorció i difusió. L'índex de la dilució del precipitat, el grau de condicions anaeròbies i el nombre i el caràcter dels llocs de l'adsorció són factors importants de control.[41]
Un model del cicle del fosfat simplificat per a un pressupost periòdic del fosfat s'utilitza per examinar com els canvis en la circulació poden influenciar la producció de l'exportació del fosfat via la font de fosfat a la zona de la utilització del fosfato i la preservació del fosfat orgànic que és controlat pel contingut en oxigen.[42] Les aplicacions del model van unir equacions: utilització del fosfat, remineralització del fosfat, i la concentració d'oxigen. Les condicions inicials per a totes les integracions del model consisteixen en els valors uniformes per a la concentració de cada component. Per a un “home estàndard” de 70 kg el fosfat disponible és ~1.52 x 10^25 molècules de fosfat en una certa forma. El fosfat disponible d'una femella humana adulta pot ser diferent de la de l'“home estàndard”.
| Component | Tipus | Nombre de molècules | Total acumulat |
|---|---|---|---|
| Membrana cel·lular | fosfat estructural | ~1.6 x 108 | ~1.6 x 108 |
| Reticle endoplasmàtic | fosfat estructural | ~1.7 x 108 | ~3.3 x 108 |
| ADN mitocondrial | fosfat estructural | ~3.3 x 108 | ~6.6 x 108 |
| ATP | 2 fosfats estructurals, 1 fosfat catalític | ~2.7 x 10⁹ | ~3.4 x 10⁹ |
| CTP | 2 fosfats estructurals, 1 fosfat catalític | ~2.7 x 10⁹ | ~6.1 x 10⁹ |
| GTP | 2 fosfats estructurals, 1 fosfat catalític | ~2.7 x 10⁹ | ~8.8 x 10⁹ |
| UTP | 2 fosfats estructurals, 1 fosfat catalític | ~2.7 x 10⁹ | ~12 x 10⁹ |
| ADN cromatina | fosfat estructural | ~6.8 x 10⁹ | ~19 x 10⁹ |
| altres | tots | ~0.4 x 10⁹ | ~19 x 10⁹ |
| tots | tots | ~19 x 10⁹ | ~19 x 10⁹ |
Referències modifica
- ↑ Butterworth PJ «Phosphate homeostasis». Mol Aspects Med., 9, 4, 1987, pàg. 289-386. PMID: 3302583.
- ↑ «DBGET Search Result: REACTION phosphate».
- ↑ «DBGET Search Result: REACTION polyphosphate».
- ↑ «KEGG PATHWAY: Pyrimidine metabolism - Reference pathway (Reaction)».
- ↑ Jin QS, Kamata M, Garcia del Saz E, Seguchi H «Ultracytochemical study of trimetaphosphatase activity during acrosomal formation in the mouse testis». Histol Histopathol., 10, 3, Jul 1995, pàg. 681-9. PMID: 7579818.
- ↑ Shimizu T, Sasaki T «Ultrastructural Study of the Effects of Cytochalasin D Administration on the Structure and Acid Trimetaphosphatase Activity of Osteoclast». J Electron Microsc (Tokyo)., 40, 5, Oct 1991, pàg. 346-55. PMID: 1666644.
- ↑ Mitchell PD «Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism». Nature., 191, Jul 1961, pàg. 144-8. PMID: 13771349.
- ↑ 8,0 8,1 Linn TC, Srere PA «Identification of ATP citrate lyase as a phosphoprotein». J Biol Chem., 254, 5, Mar 1979, pàg. 1691-8. PMID: 762167.
- ↑ Janski AM, Srere PA, Cornell NW, Veech RL «Phosphorylation of ATP Citrate Lyase in Response to Glucagon». J Biol Chem., 254, 19, Oct 1979, pàg. 9365-8. PMID: 489538.
- ↑ Irvine RF «Inositol lipids in cell signalling». Curr Opin Cell Biol, 4, 2, 1992, pàg. 212-19. PMID: 1318060.
- ↑ Nishizuka Y «Protein kinase C and lipid signaling for sustained cellular responses». FASEB J, 9, 7, 1995, pàg. 484-96. PMID: 7737456.
- ↑ 12,0 12,1 Ferry G, Tellier E, Try A, Grés S, Naime I, Simon MF, Rodriguez M, Boucher J, Tack I, Gesta S, Chomarat P, Dieu M, Raes M, Galizzi JP, Valet P, Boutin JA, Saulnier-Blache JS «Autotaxin is released from adipocytes, catalyzes lysophosphatidic acid synthesis, and activates preadipocyte proliferation. Up-regulated expression with adipocyte differentiation and obesity». J Biol Chem., 278, 20, maig 2003, pàg. 18162-9. DOI: 10.1074/jbc.M301158200. PMID: 12642576.
- ↑ 13,00 13,01 13,02 13,03 13,04 13,05 13,06 13,07 13,08 13,09 13,10 13,11 13,12 13,13 13,14 13,15 13,16 Werner A, Dehmelt L, Nalbant P «Na+-dependent phosphate cotransporters: the NaPi protein families». J Exp Biol., 201, Pt 23, Dec 1998, pàg. 3135-42. PMID: 9808829.
- ↑ Ruddy DA, Kronmal GS, Lee VK, Mintier GA, Quintana L, Domingo R Jr, Meyer NC, Irrinki A, McClelland EE, Fullan A, Mapa FA, Moore T, Thomas W, Loeb DB, Harmon C, Tsuchihashi Z, Wolff RK, Schatzman RC, Feder JN. A 1.1-Mb transcript map of the hereditary hemochromatosis locus. 7, 1997, p. 441-56.
- ↑ 15,0 15,1 15,2 15,3 15,4 Ho AM, Johnson MD, Kingsley DM «Role of the mouse ank gene in control of tissue calcification and arthritis». Science., 289, 5477, Jul 2000, pàg. 265-70. DOI: 10.1126/science.289.5477.265. PMID: 10894769.
- ↑ 16,0 16,1 16,2 16,3 16,4 Joseph Csapo «The Influence of Proteins on the Solubility of Calcium Phosphate». J Biol Chem., 75, 2, 1927, pàg. 509-15.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 Rutsch F, Vaingankar S, Johnson K, Goldfine I, Maddux B, Schauerte P, Kalhoff H, Sano K, Boisvert WA, Superti-Furga A, Terkeltaub R «PC-1 nucleoside triphosphate pyrophosphohydrolase deficiency in idiopathic infantile arterial calcification». Am J Pathol., 158, 2, Feb 2001, pàg. 543-54. PMID: 11159191.
- ↑ 18,00 18,01 18,02 18,03 18,04 18,05 18,06 18,07 18,08 18,09 18,10 18,11 18,12 18,13 18,14 18,15 Murer H, Hernando N, Forster I, Biber J «Proximal tubular phosphate reabsorption: molecular mechanisms». Physiol Rev., 80, 4, Oct 2000, pàg. 1373-409. PMID: 11015617.
- ↑ 19,0 19,1 Hernando N, Gisler SM, Pribanic S, Déliot N, Capuano P, Wagner CA, Moe OW, Biber J, Murer H «NaPi-IIa and interacting partners». J Physiol., 567, 1, Aug 2005, pàg. 21-6. DOI: 10.1113/jphysiol.2005.087049. PMID: 15890704.
- ↑ 20,0 20,1 20,2 Kavanaugh MP, Miller DG, Zhang W, Law W, Kozak SL, Kabat D, Miller AD «Cell-surface receptors for gibbon ape leukemia virus and amphotropic murine retrovirus are inducible sodium-dependent phosphate symporters». Proc Natl Acad Sci U S A., 91, 15, Jul 1994, pàg. 7071-5. PMID: 8041748.
- ↑ 21,0 21,1 21,2 21,3 21,4 21,5 21,6 21,7 Bøttger P, Hede SE, Grunnet M, Høyer B, Klaerke DA, Pedersen L «Characterization of transport mechanisms and determinants critical for Na+-dependent Pi symport of the PiT family paralogs human PiT1 and PiT2». Am J Physiol Cell Physiol., 291, 6, Dec 2006, pàg. C1377-87. PMID: 16790504.
- ↑ 22,0 22,1 22,2 22,3 Marks J, Churchill LJ, Debnam ES, Unwin RJ «Matrix extracellular phosphoglycoprotein inhibits phosphate transport». J Am Soc Nephrol., 19, 12, Dec 2008, pàg. 2313-20. PMID: 19005008.
- ↑ Quarles LD «FGF23, PHEX, and MEPE regulation of phosphate homeostasis and skeletal mineralization». Am J Physiol Endocrinol Metab., 285, 1, Jul 2003, pàg. E1-9. PMID: 12791601.
- ↑ 24,00 24,01 24,02 24,03 24,04 24,05 24,06 24,07 24,08 24,09 24,10 Lötscher M, Kaissling B, Biber J, Murer H, Levi M «Role of microtubules in the rapid regulation of renal phosphate transport in response to acute alterations in dietary phosphate content». J Clin Invest., 99, 6, Mar 1997, pàg. 1302-12. PMID: 9077540.
- ↑ 25,0 25,1 25,2 Roberts R, Sciorra VA, Morris AJ «Human type 2 phosphatidic acid phosphohydrolases. Substrate specificity of the type 2a, 2b, and 2c enzymes and cell surface activity of the 2a isoform». J Biol Chem., 273, 34, Aug 1998, pàg. 22059-67. PMID: 9705349.
- ↑ 26,0 26,1 Huang Y, Lemieux MJ, Song J, Auer M, Wang DN «Structure and mechanism of the glycerol-3-phosphate transporter from Escherichia coli». Science, 301, 5633, Aug 2003, pàg. 616-20. PMID: 12893936.
- ↑ «Major Facilitator Superfamily».
- ↑ Lide DR. CRC Handbook of Chemistry and Physics. 88a ed.. Boca Raton, Florida: CRC Press, 2007-2008, p. 7-18.
- ↑ 29,0 29,1 Schwartz MK «Phosphate metabolism». McGraw-Hill Encyclopedia of Science & Technology, 13, 9a ed., pàg. 343-4.
- ↑ Guigas G, Weiss M «Sampling the Cell with Anomalous Diffusion—The Discovery of Slowness». Biophys J., 94, 1, Jan 2008, pàg. 90-4. DOI: 10.1529/biophysj.107.117044. PMID: 17827216.
- ↑ Matsumura Y, Aizawa H, Shiraki-Iida T, Nagai R, Kuro-o M, Nabeshima Y «Identification of the human klotho gene and its two transcripts encoding membrane and secreted klotho protein». Biochem Biophys Res Commun., 242, 3, Jan 1998, pàg. 626-30. PMID: 9464267.
- ↑ Urakawa I, Yamazaki Y, Shimada T, Iijima K, Hasegawa H, Okawa K, Fujita T, Fukumoto S, Yamashita T «Klotho converts canonical FGF receptor into a specific receptor for FGF23». Nature., 444, 7120, 2006, pàg. 770-4. PMID: 17086194.
- ↑ Shimada T, Hasegawa H, Yamazaki Y, Muto T, Hino R, Takeuchi Y, Fujita T, Nakahara K, Fukumoto S, Yamashita T «FGF-23 Is a Potent Regulator of Vitamin D Metabolism and Phosphate Homeostasis». J Bone Miner Res., 19, 3, Mar 2004, pàg. 429-35. DOI: 10.1359/JBMR.0301264. PMID: 15040831.
- ↑ «Entrez Gene: FGF23 fibroblast growth factor 23».
- ↑ Kato K, Jeanneau C, Tarp MA, Benet-Pagès A, Lorenz-Depiereux B, Bennett EP, Mandel U, Strom TM, Clausen H «Polypeptide GalNAc-transferase T3 and familial tumoral calcinosis. Secretion of fibroblast growth factor 23 requires O-glycosylation». J Biol Chem., 281, 27, Jul 2006, pàg. 18370-7. PMID: 16638743.
- ↑ 36,0 36,1 36,2 36,3 Bergwitz C, Roslin NM, Tieder M, Loredo-Osti JC, Bastepe M, Abu-Zahra H, Frappier D, Burkett K, Carpenter TO, Anderson D, Garabedian M, Sermet I, Fujiwara TM, Morgan K, Tenenhouse HS, Juppner H «SLC34A3 mutations in patients with hereditary hypophosphatemic rickets with hypercalciuria predict a key role for the sodium-phosphate cotransporter NaPi-IIc in maintaining phosphate homeostasis». Am J Hum Genet., 78, 2, Feb 2006, pàg. 179-92. PMID: 16358214.
- ↑ Segawa H, Kaneko I, Takahashi A, et al. «Growth-related renal type II Na/Pi cotransporter». J Biol Chem., 277, 22, 2002, pàg. 19665-72. DOI: 10.1074/jbc.M200943200. PMID: 11880379.
- ↑ 38,0 38,1 Liu S, Guo R, Simpson LG, Xiao ZS, Burnham CE, Quarles LD «Regulation of fibroblastic growth factor 23 expression but not degradation by PHEX». J Biol Chem., 278, 39, Sep 2003, pàg. 37419-26. DOI: 10.1074/jbc.M304544200. PMID: 12874285.
- ↑ Toda K, Yabe I «Mathematical model of cell growth and phosphatase biosynthesis in Saccharomyces carlsbergensis under phosphate limitation». Biotech Bioeng., 21, 3, Feb 2004, pàg. 487-502. DOI: 10.1002/bit.260210310.
- ↑ 40,0 40,1 40,2 Wykoff DD, Rizvi AH, Raser JM, Margolin B, O'Shea EK «Positive Feedback Regulates Switching of Phosphate Transporters in S. cerevisiae». Molecular Cell., 27, 6, Sep 2007, pàg. 1005-13. DOI: 10.1016/j.molcel.2007.07.022.
- ↑ 41,0 41,1 Lijklema L, Hieltjes AHM «A dynamic phosphate budget model for a eutrophic lake». Hydrobiologia, 91-92, 1, Jul 1982, pàg. 227-33. DOI: 10.1007/BF00940113.
- ↑ Stratford K, Williams RG, Myers PG «Impact of the circulation on sapropel formation in the eastern Mediterranean». Global Biogeochemical Cycles, 14, 2, Jun 2000, pàg. 683-95.
Vegeu també modifica
Enllaços externs modifica
- extracellular+fluid al Diccionari d'eMedicine