Amoníac
L'amoníac, de noms sistemàtics trihidrur de nitrogen o azà, és un compost químic molecular, la molècula del qual consta d'un àtom de nitrogen enllaçat mitjançant enllaços simples covalents a tres àtoms d'hidrogen d'acord amb la fórmula . És un gas incolor d'olor molt penetrant. És essencial per a molts processos biològics. Es genera de manera natural a terra per bacteris, per plantes i animals en descomposició i per rebuigs animals i també és manufacturat. La major part de l'amoníac produït en plantes químiques és usat per a fabricar adobs. La resta és usada en tèxtils, plàstics, explosius, a la producció de polpa i paper, aliments i begudes, productes de neteja domèstics, refrigerants i altres productes. També s'usa en sals aromàtiques. Es dissol fàcilment en l'aigua i s'evapora ràpidament. Generalment es ven en forma de dissolució.[1]
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 17,026549096 Da |
| Epònim | Zeus Ammon |
| Descobridor o inventor | Joseph Priestley |
| Trobat en el tàxon | |
| Rol | metabòlit primari |
| Estructura química | |
| Fórmula química | NH₃ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 0,7625 kg/m³ (a 0 ℃, gas) |
| Velocitat del so | 415 m/s (0 ℃, gas) |
| PKa | 9,21 |
| Solubilitat | 34 g/100 g (aigua, 20 ℃) |
| Moment dipolar elèctric | 1,471 D |
| Punt de fusió | −77,74 ℃ −78 ℃ |
| Punt d'ebullició | −33,4 ℃ −33 ℃ (a 760 Torr) −33,33 ℃ (a 101,325 kPa) |
| Entropia molar estàndard | 192,5 J/(mol K) |
| Moment dipolar elèctric | 1,471 D |
| Entalpia estàndard de formació | −45,94 kJ/mol |
| Pressió de vapor | 8,5 atm (a 20 ℃) |
| Perill | |
| Límit inferior d'explosivitat | 15 % (V/V) |
| Límit superior d'explosivitat | 28 % (V/V) |
| Dosi letal mínima | 5.000 ppm (ésser humà, mamífers, inhalació, 5 min) 1.500 mg/m³ (ésser humà, inhalació, 30 min) 5.000 ppm (mamífers, inhalació, 5 min) 3.317 ppm (ratolí de laboratori, inhalació, 1 h) 132 mg/kg (ésser humà) |
| Dosi letal mediana | 7 g/m³ (gat, conill, inhalació, 1 h) 4.600 mg/m³ (ratolí de laboratori, inhalació, 2 h) 4.500 ppm (ratolí de laboratori, inhalació, 1 h) 4.230 ppm (ratolí de laboratori, inhalació, 1 h) 21.430 ppm (ratolí de laboratori, inhalació, 30 min) 7 g/m³ (conill, inhalació, 1 h) 18.600 mg/m³ (rata de laboratori, inhalació, 5 min) 7.040 mg/m³ (rata de laboratori, inhalació, 30 min) 2.000 ppm (rata de laboratori, inhalació, 4 h) 17.401 ppm (rata de laboratori, inhalació, 15 min) 9.500 ppm (rata de laboratori, inhalació, 1 h) 40.300 ppm (rata de laboratori, inhalació, 10 min) 28.595 ppm (rata de laboratori, inhalació, 20 min) 20.300 ppm (rata de laboratori, inhalació, 40 min) 11.590 ppm (rata de laboratori, inhalació, 1 h) 7.338 ppm (rata de laboratori, inhalació, 1 h) 4.837 ppm (ratolí de laboratori, inhalació, 1 h) 9.859 ppm (conill, gat, inhalació, 1 h) 2.000 ppm (rata de laboratori, inhalació, 1 h) |
| Temperatura d'autoignició | 651 ℃ |
| Límit d'exposició mitjana ponderada en el temps | 18 mg/m³ (10 h, cap valor) 35 mg/m³ (8 h, Estats Units d'Amèrica) 25 ppm (, Egipte, Austràlia, Índia, Japó, Corea del Sud, Mèxic, Nova Zelanda, Noruega, Perú, Suècia, Turquia, Regne Unit) 20 ppm (, Àustria, Bèlgica, Dinamarca, Finlàndia, Alemanya, Islàndia) 14 mg/m³ (, Comissió Europea, Hongria, Països Baixos) 10 ppm (, França) 20 mg/m³ (, Polònia) 50 ppm (, Tailàndia, Filipines) |
| Límit d'exposició a curt termini | 27 mg/m³ (Polònia) 35 ppm (Austràlia, Índia, Corea del Sud, Mèxic, Nova Zelanda, Perú) 50 ppm (Bèlgica, Finlàndia, Islàndia, Suècia) 36 mg/m³ (Comissió Europea, Hongria) 20 ppm (França) 20 mg/m³ (Rússia) |
| IDLH | 210 mg/m³ i 300 ppm |
| Potencial d'escalfament global | 0 |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
Història
modificaL'amoníac era conegut pels alquimistes com esperit volàtil, i en descriviren la seva obtenció i propietats. L'obtenien escalfant orina amb sal (clorur de sodi) i tractant el producte format amb àlcalis. Una sal seva, el clorur d'amoni, s'importava d'Egipte, on es preparava a partir del sublimat que es forma en cremar els fems dels camells. També escalfant peülles i banyes d'animals, es desprenia amoníac, i la seva dissolució aquosa era coneguda com a esperit de banya de cérvol.[2]
El nom sistemàtic azà adoptat per la IUPAC té l'arrel az- que prové del francès azote 'nitrogen', i aquest del grec ἀ- a- 'sense' i ζῳή zōiḗ 'vida', per tractar-se el nitrogen d'un gas inert, que no permet la vida;[3] i de la terminació -à, que fa referència als hidrurs dels no-metalls a la nomenclatura química actual. Per altra banda l'etimologia del nom comú amoníac prové del llatí ammoniăcum 'goma resinosa medicinal', i aquest del grec ἀμμωνιακόν ammōniakón; pròpiament 'del país d'Ammó', perquè procedia a l'oasi de Siwa situat al nord-oest d'Egipte, al desert de Líbia, on s'erigia el famós oracle d'Ammó.[4] Prop d'aquest temple hi havia un lloc on els visitants hi deixaven els seus camells quan anaven a resar i on s'hi acumulà amb els anys una gran quantitat de fems. D'aquest dipòsit s'hi obtenia el clorur d'amoni que s'exportava.[5]
El 1782 el químic suec Torbern Olof Bergman (1735-1784) analitzà aquest clorur d'amoni i obtingué un gas que anomenà amoníac pel seu origen. L'anglès Joseph Priestley (1733-1804) també l'obtingué el 1874 i l'anomenà aire alcalí i el francès Claude Louis Berthollet (1748-1822) en determinà la seva composició el 1785 descomponent-lo en hidrogen i nitrogen mitjançant descàrregues elèctriques.[6]
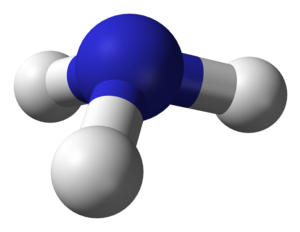
Estructura molecular
modificaLa molècula d'amoníac no és plana, sinó que té la forma de piràmide de base triangular. Els tres hidrogen estan situats a cadascun dels vèrtex d'aquesta base triangular i el nitrogen al vèrtex superior. L'estructura de la molècula es pot explicar sobre la base de la teoria d'enllaç de valència. El nitrogen forma orbitals híbrids sp3 que estan dirigits segons els vèrtex d'un tetraedre i separats uns dels altres per 109,5°. Tres d'aquests orbitals formen enllaços σ amb els orbitals 1s dels hidrògens quedant un orbital sp3 amb una parella d' electrons que no formen enllaç. Aquesta parella, pel fet de no formar enllaç, es troba més molt propera al nitrogen que les altres tres i les repel·leix reduint lleugerament els tres angles entre els enllaços σ que passa de 109,5° a 107,3°. La longitud d'enllaç és de 101,7 pm. Són enllaços covalents polaritzats degut a la diferència d'electronegativitats dels dos àtoms. El és més electronegatiu i atreu els electrons dels tres enllaços cap a ell, quedant amb una certa densitat de càrrega negativa mentre que els àtoms d' queden amb una densitat de càrrega positiva.[7][8][9]
Propietats
modificaPropietats físiques
modificaL'amoníac és un gas a temperatura ambient (densitat 0,5967 vegades la de l'aire), incolor i d'olor característica molt irritant. El seu punt d'ebullició és de –33,35 °C i el de solidificació –77,7 °C. És molt soluble en aigua (34% a 20 °C) essent un procés exotèrmic (es desprenen 37,1 kJ/mol), i la seva solubilitat disminueix amb la temperatura com tots els gasos (47% a 0 °C; 38% a 15 °C; 31% a 25 °C; 28% a 30 °C; 18% a 50 °C). També és soluble en etanol (20% a 0 °C; 10% a 25 °C); en metanol (16% a 25 °C), en cloroform i en dietilèter.[10]
L'amoníac líquid se sembla a l'aigua en molts d'aspectes. És un important dissolvent de molts de composts inorgànics, i dissol millor que l'aigua algunes substàncies orgàniques. En estat líquid és un mal conductor del corrent elèctric, car està molt feblement ionitzat en ions amoni i anions amida :
Molts electròlits es dissolen en amoníac líquid i condueixen el corrent elèctric. Els diversos tipus de reaccions que tenen lloc en dissolució aquosa també es donen en amoníac líquid. Tanmateix, com que les relacions de solubilitat en aquest no són sempre les mateixes que en l'aigua, les reaccions solen seguir camins diferents. Així el clorur d'argent és insoluble en aigua i soluble en amoníac líquid, i el clorur de bari és soluble en aigua i insoluble en amoníac líquid.[2]
Propietats químiques
modificaDescomposició
modificaL'amoníac és molt estable. Tanmateix, es pot descompondre en hidrogen i nitrogen passant per sobre de catalitzadors metàl·lics escalfats o quan s'hi produeixen descàrregues elèctriques:
Propietats àcid-base
modificaEn dissolució aquosa es comporta com una base forta, formar-se el catió amoni, . La constant d'equilibri de la reacció a temperatura ambient val 1,81×10–5 o pKb = 4,74:[11]
Les seves dissolucions aquoses són molt bàsiques, tenen un pH molt alt: 11,6 per a una dissolució 1,0 mol/l; 11,1 per a 0,1 mol/l; i 10,6 per a 0,01 mol/l.[10]
Reacciona amb els àcids neutralitzant-los i donant les sals d'amoni. Per exemple amb el clorur d'hidrogen dona el clorur d'amoni:[2]
Reaccions amb no-metalls
modificaReacciona difícilment amb l'oxigen, per la qual cosa és estable en presència d'aire. Amb oxigen reacciona donant una flama groga i produint nitrogen i aigua:
Si la combustió es realitza en presència de platí o d'una mescla de platí i rodi a 750–900 °C la reacció dona monòxid de nitrogen o diòxid de nitrogen segons les reaccions:[11] Amb clor reacciona donant diferents productes en funció de les condicions: , , , , , i . Amb fluor reacciona donant trifluorur de nitrogen amb una flama de color groc verdós segons la reacció:
Amb carboni calent al vermell dona cianur d'amoni i hidrogen; amb fòsfor forma fosfà i hidrogen; amb sofre es transforma en sulfur d'hidrogen i tetrasulfur de tetranitrogen .[11]
Reaccions amb metalls i òxids
modificaAlguns metalls, com ara el liti i el magnesi, reaccionen directament amb amoníac a alta temperatura formant els corresponents nitrurs i alliberant hidrogen:[2]
Amb sodi i potassi, només una part de l'hidrogen reacciona i es formen les amides de sodi i de potassi respectivament:[2]
L'amoníac reacciona com a reductor amb molts d'òxids quan es fa passar damunt d'ells a alta temperatura. Per exemple amb l'òxid de coure(II) dona nitrogen, coure i vapor d'aigua:[2]
Formació de complexos de coordinació
modificaL'amoníac és un lligand neutre que reacciona amb cations per donar complexos de coordinació. És el cas de la reacció amb el catió argent(1+) per formar el complex incolor diamninaargent(1+) :
Els complexos més destacats i els seus colors són: blau fosc, violat, taronja i incolor. També participa en complexos juntament amb d'altres lligands, com ara l'aigua, per exemple blau verdós, blau,[12]
Síntesi
modificaEl procés de Haber-Bosch és l'únic mètode de síntesi d'amoníac emprat per la industria en l'actualitat. És un mètode de síntesi directa d'amoníac a partir d'hidrogen i nitrogen, segons l'equilibri:
Fou desenvolupat pel químic físic alemany Fritz Haber (1868-1934) pel qual rebé el premi Nobel de Química el 1918, ja que aconseguí fer factible la fabricació d'amoníac de forma econòmica. El mètode es traduí en un procés a gran escala mitjançant un catalitzador i emprant alta pressió per Carl Bosch (1874-1940), químic industrial que guanyà el premi Nobel el 1931 conjuntament amb Friedrich Bergius pels estudis d'alta pressió.[13]
El procés de Haber-Bosch fou el primer procés químic industrial a utilitzar alta pressió per a una reacció química. Combina directament el nitrogen de l'aire amb l'hidrogen a pressions extremadament altes (200–400 atm) i a temperatures relativament baixes (400–650 °C). L'alta pressió afavoreix la producció d'amoníac perquè durant la reacció hi ha una disminució del nombre de molècules (de 4 es passa a només 2) i també a baixes temperatures, ja que la reacció desprèn calor, és exotèrmica ( ).[2]
Però en baixar la temperatura es veu afectada la cinètica de la reacció que es ralentitza de manera que deixa de ser un procés pràctic. Un catalitzador fabricat majoritàriament amb ferro, molibdè i un poc d'òxid d'alumini permet que la reacció es dugui a terme ràpidament a una temperatura inferior a la necessària per a una velocitat de reacció òptima sense catalitzador. Per altra banda, l'eliminació d'amoníac de la mescla tan bon punt es forma, garanteix que es mantingui un equilibri que afavoreixi la formació del producte.[2]
Aplicacions
modificaL'amoníac ocupa el segon lloc, després de l'àcid sulfúric, com la substància química que s'obté industrialment en major quantitat. S'està produint cada cop més als països que disposen de fonts de gas natural i carbó a baix cost (la Xina i Rússia representen el 40% aproximadament). Les plantes més grans produeixen unes 3 000 tones al dia i hi ha previst construir plantes que produeixin 4 000–5 000 tones al dia, cosa que suposaria que la producció mundial total es podria assolir amb 100 plantes d'aquest tipus. El 2016 la producció mundial era de 146 milions de tones, de les quals se'n produïen 48 milions a la Xina, 12 milions a Rússia, 11 milions a l'Índia, 9 milions als EUA, 5 milions a Indonèsia i la resta a altres països.[14]
Producció de fertilitzants
modificaEl 85% de la producció mundial es dedica a l'obtenció de fertilitzants (fosfat d'amoni, nitrat d'amoni, nitrat d'amoni i calci, urea i dissolucions d'amoníac). Un 5% s'empra en la síntesi de poliamides, un altre 5% en la producció d'àcid nítric i l'altre 5% en altres aplicacions. Una quantitat creixent d'amoníac, tot i que encara és petita en comparació amb altres usos, s'utilitza com a solució concentrada per combatre l'abocament d'òxids de nitrogen de les centrals tèrmiques.[14]
Netejador
modificaLes dissolucions d'amoníac s'empren per a usos domèstics. Com que elimina la duresa temporal de l'aigua, s'empra per a netejar i rentar, amb estalvi de sabó. És un bon desengreixant i s'empra per eliminar restes de greixos de les vaixelles, dels forns, de les cuines, etc. També s'empra en la neteja de taques a la roba, a estores, etc.[2] El poder desengreixant de l'amoníac es deu al fet que reacciona amb els olis i greixos, que són insolubles en aigua, i els transforma (reacció de saponificació) formant una emulsió de glicerol i de sabó, que permet rentar-los amb l'aigua.[15]
Refrigerant
modificaL'amoníac s'empra com a gas refrigerant amb el codi R-717, especialment aplicable en grans plantes industrials on els seus avantatges es poden aprofitar completament sense comprometre la seguretat. L'amoníac és conegut per les seves favorables propietats termodinàmiques. En una àmplia gamma d'aplicacions, supera els refrigerants sintètics. Té una eficiència teòrica lleugerament superior a la del tetrafluoroetà o R-134a o del propà o R-290. A la pràctica, hi ha proves que els sistemes d'amoníac funcionen fins i tot millor que en teoria. Tot i això, presenta diversos inconvenients que fins ara han evitat l'ús d'amoníac en aplicacions comercials, per exemple compatibilitat de materials, toxicitat i inflamabilitat.[16]
Medi ambient
modificaL'amoníac és fàcilment biodegradable, les plantes l'absorbeixen amb molta facilitat eliminant-lo del medi, de fet és un nutrient molt important per al seu desenvolupament. Encara que concentracions molt altes en l'aigua, com tot nutrient, pot causar greus danys en un riu o estany, ja que l'amoníac interfereix en el transport d'oxigen per l'hemoglobina.
Efectes nocius
modificaL'exposició a altes concentracions d'amoníac en l'aire pot produir cremades greus a la pell, ulls, gola i pulmons.[1] En casos extrems pot ocórrer ceguesa, danys pulmonars i la mort. Respirar concentracions més baixes pot causar tos i irritació del nas i el coll.
Si una persona s'empassa amoníac pot patir cremades a la boca, la gola i l'estómac. Vessar amoníac concentrat sobre la pell causarà cremades. Els estudis en animals demostren efectes similars als observats en éssers humans. No se sap si l'amoníac afecta la reproducció en éssers humans.
Referències
modifica- ↑ 1,0 1,1 «Amoníac». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 Babor, Joseph A.. Química general moderna : una introducción a la química física y a la química descriptiva superior (inorgánica, orgánica y bioquímica). 8{487} ed., reimp. Barcelona: Marín, imp. 1979. ISBN 8471029979.
- ↑ ASALE, RAE-; RAE. «ázoe | Diccionario de la lengua española» (en castellà). [Consulta: 20 novembre 2019].
- ↑ ASALE, RAE-; RAE. «amoniaco | Diccionario de la lengua española» (en castellà). [Consulta: 19 novembre 2019].
- ↑ Balmaceda, D. Historia de las palabras. Argentina: Penguin Random House Grupo Editorial, 2011. ISBN 9789500736848.
- ↑ Myers, Richard L. (Richard Leroy), 1951-. The 100 most important chemical compounds : a reference guide. Westport, Conn.: Greenwood Press, 2007. ISBN 9780313080579.
- ↑ Cartmell, E. (Edward). Valency and molecular structure. Fourth edition. ISBN 9781483140605.
- ↑ Introduction to general, organic, and biochemistry. 8th ed. Belmont, CA: Thomson Brooks/Cole, 2007. ISBN 0495011975.
- ↑ Organic chemistry. 6th ed. Belmont, CA: Brooks/Cole, Cengage Learning, 2012. ISBN 9780840054982.
- ↑ 10,0 10,1 PubChem. «Ammonia» (en anglès). [Consulta: 19 novembre 2019].
- ↑ 11,0 11,1 11,2 Greenwood, N. N. (Norman Neill). Chemistry of the elements. 2a edició. Boston, Mass.: Butterworth-Heinemann, 1997. ISBN 0585373396.
- ↑ Jorgensen, C. K.. Inorganic Complexes.. Burlington: Elsevier Science, 1963. ISBN 9780323159692.
- ↑ «Haber-Bosch process | chemistry» (en anglès). [Consulta: 20 novembre 2019].
- ↑ 14,0 14,1 Lichtarowicz, Marek. «Ammonia» (en anglès). [Consulta: 20 novembre 2019].
- ↑ Ramsden, E. N.. Key science chemistry. 3a edició. Cheltenham: Nelson Thornes, 2001. ISBN 0-7487-6242-6.
- ↑ «Ammonia in refrigeration | Natural refrigerants | NH₃ | Danfoss». [Consulta: 21 novembre 2019].
Enllaços externs
modifica- Agència per a substàncies tòxiques i el registre de malalties (EUA): Ressenya toxicològica. (Informació de domini públic). (anglès)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Fitxa internacional de seguretat química de l'amoníac. (castellà)
