Cromosoma
En biologia, un cromosoma (del grec χρώμα khroma, 'color', i σώμα soma, 'cos') és cadascun dels petits cossos amb forma de bastonets que s'organitzen a la cromatina del nucli cel·lular durant les divisions cel·lulars (mitosi i meiosi) dels organismes eucariotes. La cromatina és un material microscòpic que porta la informació genètica dels organismes eucariotes i està composta d'ADN associat a proteïnes especials anomenades histones. Aquest material es troba al nucli de les cèl·lules eucariotes i té l'aspecte d'un embull de fils prims. Quan el nucli cel·lular comença el procés de divisió (cariocinesi), aquest embull de fils inicia un fenomen de condensació progressiu que finalitza en la formació d'entitats diferenciades i independents, els cromosomes. Per tant, cromatina i cromosoma són dos aspectes morfològicament diferents d'una mateixa entitat cel·lular.[1]
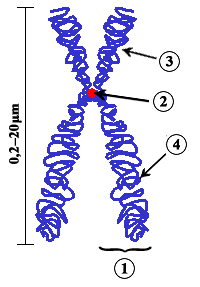
Quan s'examinen amb detall durant la mitosi, s'observa que els cromosomes tenen una forma i una mida característiques. Cada cromosoma té una regió condensada o constreta anomenada centròmer, que confereix l'aparença general de cada cromosoma i que permet classificar-los segons la seva posició. El nombre de cromosomes dels individus d'una mateixa espècie és constant en els individus sans. Els eucariotes de reproducció asexual tenen una quantitat n de cromosomes, mentre que els eucariotes de reproducció sexual tenen 2n cromosomes (tenen dues còpies de cada cromosoma), excepte els gàmetes que també en tenen només n. Quan s'examina la longitud d'aquests cromosomes i la situació del centròmer sorgeix el segon tret general: per cada cromosoma amb una longitud i una posició del centròmer determinades existeix un altre cromosoma amb trets idèntics, és a dir, gairebé tots els cromosomes es troben formant parelles. Els membres de cada parella s'anomenen cromosomes homòlegs.
A la imatge de la dreta es tenen tots els cromosomes mitòtics d'una nena, ordenats per parelles homòlogues i per la seva longitud, el que s'anomena cariotip. En aquest cariotip hi ha 46 cromosomes (o sigui, 2n = 46) que és el número cromosòmic de l'espècie humana. Cada cromosoma té una estructura doble, amb dues cromàtides germanes que estan paral·leles entre si unides per un únic centròmer. Durant la mitosi. les cromàtides germanes, que són idèntiques, se separen l'una de l'altra cap a dues noves cèl·lules. Les parelles de cromosomes homòlegs que s'observen en la imatge tenen, a més, una semblança genètica fonamental: tenen els mateixos gens situats als mateixos llocs al llarg del cromosoma (aquests llocs s'anomenen locus o loci en plural). Això implica que cada membre del parell d'homòlegs porta informació genètica pels mateixos caràcters de l'organisme. En organismes amb reproducció sexual, un dels membres del parell de cromosomes homòlegs prové de la mare (a través de l'òvul) i l'altre del pare (a través de l'espermatozoide). Per això, i a conseqüència de l'herència biparental, cada organisme diploide té dues còpies de cada gen, cadascuna ubicada en un dels cromosomes homòlegs.[1] Una excepció important en el concepte de parelles de cromosomes homòlegs és que en moltes espècies els membres d'una parella, els cromosomes que determinen el sexe (cromosomes sexuals) normalment no tenen la mateixa mida, igual situació del centròmer, la mateixa proporció entre els braços o, fins i tot, els mateixos loci. A la imatge s'hi pot observar que el cromosoma Y (que determina el sexe masculí en humans) és de menor mida i no té la majoria de loci que estan al cromosoma X.[1][2]
Història i definicions
modificaDes d'un punt de vista etimològic, la paraula «cromosoma» prové del grec i significa 'cos que es tenyeix', mentre que la paraula «cromatina» significa 'substància que es tenyeix'. Els cromosomes foren observats en cèl·lules de plantes pel botànic suís Karl Wilhelm von Nägeli el 1842 i, independentment, pel científic belga Edouard Van Beneden en cucs del gènere Ascaris.[3][4] L'ús de drogues basofíliques (p. ex. les anilines) com a tècnica citològica per observar el material nuclear fou fonamental pels descobriments posteriors. Així, el citòleg alemany Walther Flemming va definir inicialment el 1892 la cromatina com «la substància que constitueix els nuclis interfàsics i que mostra determinades propietats de la tinció».[5] Per tant, les definicions inicials de "cromosoma" i "cromatina" eren purament citològiques. La definició biològica va arribar a principis del segle xx amb el redescobriment de les lleis de Mendel: tant la cromatina com el cromosoma constitueixen el material genètic organitzat. Per això, foren fonamentals els treballs del neerlandès Hugo de Vries (1848-1935), l'alemany Carl Correns (1894-1933) i l'austríac Erich von Tschermak-Seysenegg (1871-1962), els grups de recerca dels quals van redescobrir independentment les lleis de Mendel i van associar els factors genètics o gens als cromosomes.[6]
El primer investigador que va aïllar ADN fou el suís Friedrich Miescher, entre el 1868 i 1869, quan realitzava els seus estudis postdoctorals al laboratori d'Ernst Felix Hoppa-Seyler (un dels fundadors de la bioquímica, la fisiologia i la biologia molecular) a Tübingen. Miescher estava analitzant la composició química del pus dels embenatges usats de l'hospital, per la qual cosa va aïllar nuclis i va comprovar que estaven formats per una única substància química molt homogènia, no proteica, que denominà "nucleïna". No obstant això, fou Richard Altmann el 1889 qui va encunyar el terme àcid nucleic, quan es demostrà que la nucleïna tenia propietats àcides. En 1881, Zacharias demostrà que els cromosomes estaven formats químicament per nucleïna, establint la primera associació entre les dades citològiques i bioquímiques.
Les primeres observacions de la divisió cel·lular (la mitosi, durant la qual la cèl·lula mare reparteix els seus cromosomes entre dues cèl·lules filles), foren realitzades entre el 1879 i el 1882 per Walther Flemming i Robert Feulgen, de forma independent, gràcies al desenvolupament de noves tècniques de tinció. L'associació entre l'herència i els cromosomes fou feta poc després (1889) per August Weismann, de manera teòrica i gairebé intuïtiva. Però les primeres dades experimentals que van permetre a Walter Sutton[7] i Theodor Boveri[8] proposar que els "factors" de Mendel eren unitats físiques que se situaven als cromosomes (el que s'anomena sovint la teoria cromosòmica Boveri-Sutton) daten de 1902. Aquestes idees van romandre controvertides fins que Thomas Hunt Morgan va realitzar els experiments que avui es consideren clàssics sobre els trets genètics lligats al sexe, publicats el 1910 i que li van valdre el Premi Nobel el 1933.[9]
La demostració que els gens estan als cromosomes fou feta per Calvin Bridges i Nettie Stevens el 1912 i fou Alfred Henry Sturtevant qui va mostrar que els gens es disposaven linealment al llarg del cromosoma i va elaborar el primer mapa genètic d'un organisme, Drosophila melanogaster. Les bases fonamentals de l'herència van quedar definitivament establertes el 1915, quan es publicà el llibre El mecanisme de l'herència mendeliana de Thomas Hunt Morgan, Alfred Strurtevant, Hermann Muller i Calvin Bridges.[10] El 1919 Phoebus Levene va identificar que un nucleòtid està format per una base, un sucre i un fosfat,[11] iniciant així l'anàlisi molecular de l'ADN, que portaria a la comprensió dels mecanismes moleculars de l'herència.
En els organismes eucariotes els cromosomes estan formats per tres tipus diferents de molècules: l'ADN, les histones i les proteïnes no històniques. De fet, els cromosomes eucariotes són molècules molt llargues d'ADN de doble hèlix que interaccionen amb les proteïnes (histones i no histones) i es poden trobar en estat relaxat o poc compactat, com en els nuclis de les cèl·lules durant la interfase; o en estat altament compactat, com succeeix a la metafase mitòtica.
Cronologia dels descobriments
modifica- 1841: Els cromosomes són descoberts per Karl Wilhelm von Nägeli.
- 1869: Friedrich Miescher descobreix l'ADN.
- 1889: Wilhelm von Waldeyer els dona el nom de cromosoma, que significa "cos acolorit" en grec.
- 1910: Thomas Hunt Morgan determina que els cromosomes són els portadors dels gens.
- 1943: Oswald Avery, C. McLeod i M. McCarty descobreixen que l'ADN és el material hereditari.
- 1953: James Dewey Watson i Francis Harry Compton Crick descobreixen l'estructura de l'ADN.
- 1966: Severo Ochoa completa el codi genètic.
- 1972: D. Jackson, R. Symons i P. Berg creen la primera molècula artificial.
- 1973: J. Boyer i S. Cohen clonen bacteris.
- 1977: Frederick Sanger descobreix la seqüenciació de l'ADN.
- 1978: Producció d'una proteïna humana en bacteris.
- 1981: Es fa el primer diagnòstic prenatal.
- 1982: Es creen els primers organismes transgènics.
- 1983: Seqüenciació dels primers genomes sencers.
- 2001: Seqüenciació del genoma humà.
Estructura i composició química de la cromatina
modificaEls principals components que s'obtenen quan s'aïlla la cromatina dels nuclis interfàsics són l'ADN, les proteïnes històniques, les proteïnes no històniques i l'ARN. La quantitat de proteïnes no histones pot variar d'uns teixits a altres en el mateix individu i dins del mateix teixit al llarg del desenvolupament.
Histones
modificaLes histones són proteïnes bàsiques, riques en residus de lisina i arginina, que mostren una elevada conservació evolutiva i que interaccionen amb l'ADN formant una subunitat que es repeteix al llarg de la cromatina, anomenada nucleosoma. Els principals tipus d'histones que s'han aïllat en els nuclis interfàsics en diferents espècies eucariotes són H1, H2A, H2B, H3 i H4. A més d'aquestes histones, també n'hi ha d'altres que són específiques de cada teixit, com la histona H5 molt rica en lisina (25%) específica d'eritròcits nucleats de vertebrats no mamífers i les histones de l'endosperma.[12] Així mateix, la cromatina centromèrica es caracteritza per la presència d'una isoforma específica de la histona H3, anomenada CENP-A en els vertebrats.
Una de les característiques més destacables és el seu elevat conservadorisme evolutiu, sobretot en les histones H3 i H4. La histona H4 de pèsol i de tim de vedella difereixen en només dos aminoàcids. Aquesta data indica que les interaccions entre l'ADN i les histones per formar la cromatina han de ser molt semblants en tots els organismes eucariotes.
Els gens que codifiquen les histones s'agrupen en nínxols (o clústers) que es repeteixen desenes o centenars de vegades. Cada clúster o grup conté el següent ordre de gens que codifiquen histones: H1-H2A-H3-H2B-H4. Aquests gens són rics en parells GC, ja que codifiquen proteïnes amb un elevat contingut en lisina i arginina, però estan separats per seqüències espaiadores riques en parells AT.[13][14][12][15][16]
Nucleosoma
modificaLa cromatina de nucli durant la interfase, quan s'observa mitjançant tècniques de microscòpia electrònica, es pot descriure com un collar de comptes o un rosari, en què cada compte és una subunitat esfèrica o globular que s'anomena nucleosoma; els nucleosomes estan units entre si mitjançant fibres d'ADN. Així doncs, la unitat bàsica de l'estructura de la cromatina és el nucleosoma. Un nucleosoma típic està associat a 200 parells de bases (pb) d'ADN i està format per una medul·la (core en anglès) i un lligador (o linker). La medul·la està formada per un octàmer constituït per dues subunitats de les histones H2A, H2B, H3 i H4. En altres paraules, es tracta d'un dímer: 2 × (H2A, H2B, H3, H4). Els treballs d'Aaron Klug i els seus col·laboradors[17][18] sobre la disposició de les histones a la medul·la dels nucleosomes li van valdre el Premi Nobel de química el 1982. Al voltant de la medul·la s'hi enrotlla l'ADN (140 pb) donant gairebé dues voltes (una volta i tres quarts). La resta de l'ADN (60 pb) forma part del lligador, que interacciona amb la histona H1. La quantitat d'ADN associat amb un nucleosoma varia d'una espècie a l'altra, de 154 pb a 241 pb; aquesta variació es deu fonamentalment a la quantitat d'ADN associada al lligador.[13]
Les fibres d'ADN dúplex nu tenen un gruix de 20 Å. L'associació de l'ADN amb les histones genera els nucleosomes, que tenen uns 100 Å de diàmetre. Al seu torn, els nucleosomes es poden enrotllar helicoidalment per formar un solenoide (una espècie de molla) que constitueix les fibres de cromatina dels nuclis interfàsics amb un diàmetre aproximat de 300 Å. Els solenoides es poden tornar a enrotllar per donar lloc a supersolenoides amb un diàmetre de 4.000 Å a 6.000 Å, que constituirien les fibres dels cromosomes metafàsics.[17][18]
Proteïnes cromosòmiques no històniques
modificaLes proteïnes cromosòmiques no històniques són proteïnes diferents de les històniques que s'extreuen de la cromatina dels nuclis amb NaCl 0,35M (solució salina). Tenen un alt contingut en aminoàcids bàsics (25% o més), un alt contingut en aminoàcids àcids (20-30%), una elevada proporció de prolina (7%), un baix contingut en aminoàcids hidròfobs i una alta mobilitat electroforètica. Les proteïnes cromosòmiques no històniques que s'extreuen de la cromatina dels nuclis varien molt segons la tècnica d'aïllament emprada. Un grup d'aquestes proteïnes cromosòmiques no històniques tenen una alta mobilitat electroforètica i s'anomenen de manera abreujada HMG (high mobility group, "grup d'alta mobilitat").
Les proteïnes HMG
modificaAquestes proteïnes s'agrupen en una superfamília per les seves semblances físiques i químiques, i perquè totes elles actuen com a elements arquitectònics que afecten múltiples processos dependents de l'ADN en el context de la cromatina. Totes les HMG tenen un terminal carboxílic ric en aminoàcids de tipus àcid, i es classifiquen en tres famílies (HMGA, HMGB i HMGN), cadascuna amb un motiu funcional únic que indueix canvis específics en els seus llocs d'unió i participa en funcions cel·lulars diferents.[19]
La família HMGA consta de quatre membres, i tots ells contenen un motiu funcional característic, anomenat "ganxo AT" (AT hook). A través d'aquestes seqüències, les HMGA s'uneixen preferencialment a seqüències riques en AT d'ADN en forma-B i indueixen canvis de conformació que indueixen la unió de components addicionals. Les proteïnes HMGA tenen una cua C-terminal àcida, que podria ser important per la interacció amb altres proteïnes. Tradicionalment, aquest grup es denominava HMG-I/Y.[20]
La família HMGB consta de tres variants, cadascuna de les quals conté dos motius funcionals (les caixes HMG) i un extrem C-terminal molt àcid. Les caixes HMG estan formades per tres α-hèlixs plegades conjuntament per formar una estructura amb forma de L, que en part s'introdueix en la fenedura menor de l'ADN, plegant-lo intensament. Hi ha lleugeres diferències entre les caixes HMG de les diferents HMGB, cosa que confereix especificitat a cadascuna d'elles. Les cues àcides modulen l'afinitat per una varietat d'estructures d'ADN distorsionat.[19] Tradicionalment aquestes proteïnes s'anomenaven proteïnes HMG-1/-2.[20]
La família de proteïnes HMGN es caracteritza per un domini carregat positivament, el domini d'unió a nucleosomes, i per una cua C-terminal àcida, el domini de desplegat de la cromatina. Les proteïnes HMGN s'uneixen específicament als nucleosomes i alteren tant l'estructura local com l'estructura de nivell superior de la cromatina.[19] Aquestes proteïnes es coneixien tradicionalment com la subfamília HMG-14/-17.[20]
S'han detectat més de vint proteïnes HMG; les proteïnes HMG-1/-2 (HMGB) i HMG-14/-17 (HMGA) s'han identificat en totes les espècies de mamífers, ocells i peixos estudiades fins al moment. Les proteïnes HMG-1/-2 només estan al nucli, estan implicades en la replicació, s'uneixen preferentment a ADN d'hèlix senzilla, desenrotllen l'ADN dúplex i s'estima que hi ha una molècula d'HMG-1 o HMG-2 per cada quinze nucleosomes. Les proteïnes HMG-14/-17 estan al nucli i al citoplasma, estan relacionades amb la regulació de la transcripció i s'estima que hi ha una molècula d'HMG14 o HMG-17 per cada deu nucleosomes.
La carcassa proteica dels cromosomes
modificaMolts estudis citogenètics mostren que l'ADN està intensament enrotllat quan s'observa al microscopi. El primer nivell de compactació lineal de l'ADN és l'obtingut pel plegament de la fibra de l'ADN al voltant dels nucleosomes,[21] responsable del primer nivell de plegament lineal (de sis a set vegades). El següent nivell de plegament correspon a l'anomenada "fibra de 30 nm", que és el que s'observa en nuclis en interfase. Encara que hi ha hagut molta controvèrsia per descriure aquesta estructura,[22] la fibra de 30 nm es considera normalment com l'enrotlladora helicoidal de les fibres dels nucleosomes, que genera la compactació unes altres sis o set vegades. Durant la mitosi, la fibra de 30 nm es compacta 200-500 vegades més fins a assolir el diàmetre observat al microscopi per les fibres cromosòmiques durant la divisió cel·lular (~ 700 nm).[23] Per tant, s'han hagut de produir nous superenrotllaments. Tanmateix, l'explicació d'aquests plegaments d'ordre superior ha generat gran controvèrsia.[22]
El 1977, Laemmli i col·laboradors van aconseguir aïllar cromosomes metafàsics mancats d'histones mitjançant un tractament amb sulfat de dextrà i heparina.[24] Aquests cromosomes metafàsics desproveïts d'histones tenen una medul·la central densament tenyida que ha sigut anomenada scaffold ("carcassa"). Aquesta carcassa proteica és resistent a l'acció de l'ADNasa, l'ARNasa i també a solucions de ClNa 2M. No obstant això, desapareix per tractaments amb urea 4M i dodecil sulfat sòdic o amb enzims proteolítics. Per tant, es tracta d'una carcassa proteica.
L'observació al microscopi electrònic mostra que d'aquesta carcassa proteica en surten i arriben llaços o fibres que es poden fer desaparèixer mitjançant tractaments amb ADNasa. Per tant, aquests llaços o dominis que arranquen de l'armadura proteica són llaços d'ADN. Un dels principals components de la carcassa proteica és l'enzim topoisomerasa II α (topoIIα),[25][26] un enzim que produeix talls en l'ADN dúplex a nivell de les dues hèlixs. La topoisomerasa II intervé durant la replicació de l'ADN creant o relaxant els superenrotllaments. En mamífers hi ha dues isoformes d'aquest enzim (α i ß), amb propietats similars in vitro. Tanmateix, encara que α i β es comporten in vitro de manera similar a la interfase, a la mitosi tenen un comportament diferent: només la topoIIα està associada majoritàriament als cromosomes.[27] La presència de la topoisomerasa II α només a la carcassa proteica suggereix que apareix a la base dels llaços o dominis d'ADN, indicant que aquesta organització en dominis podria estar relacionada amb la replicació i la transcripció. Altres enzims, com la topoisomerasa I, que produeix talls en l'ADN dúplex a nivell d'una sola hèlix i la HMG-17, apareixen només als llaços o dominis i no a la carcassa proteica. Les proves existents fins ara suggereixen que les fibres de solenoides (30 nm) formarien els llaços o dominis que sorgeixen de la carcassa proteica i que aquesta carcassa estaria al seu torn enrotllada formant una espiral.[24]
A més de l'enzim topoisomerasa II α, l'altre component fonamental proposat de l'armadura proteica és la condensina 13s.[28] La tinció doble amb anticossos contra topoIIα i condensina genera una carcassa amb aspecte d'un "pal de barber" (un cilindre amb bandes espirals vermelles i blanques que simbolitza l'antiga doble professió dels barbers com cirurgians), en què alternen "comptes" enriquits en topoIIα i en condensina. Aquesta estructura sembla estar generada per dues cadenes juxtaposades. Sembla que l'acoblament d'aquesta carcassa proteica té lloc en dues fases, ja que la condensina només s'associa en la transició de profase a metafase durant la mitosi. Tanmateix, el paper estructural de la topoIIα en l'organització dels cromosomes encara es discuteix, ja que altres grups argumenten que aquest enzim s'intercanvia ràpidament tant en els braços cromosòmics com en els cinetocors durant la mitosi.[29][27]
Els dominis d'ADN semblen estar units a la carcassa proteica per unes regions específiques anomenades de manera abreujada SAR (scaffold associated regions, també anomenades MARS, matrix attachment regions) que es detecten quan els cromosomes metafàsics mancats d'histones es tracten amb endonucleases de restricció.[30] Després d'aquest tractament queden regions d'ADN unides a la carcassa que, al seu torn, resisteixen a la digestió amb exonucleases gràcies al fet que estan protegides per una proteïna. Quan es digereix aquesta proteïna, les regions d'ADN protegides contenen seqüències de centenars de parells de bases que són molt riques en AT i que tenen llocs d'unió per topoisomerasa II i histona H1. Aquestes regions d'unió específica dels dominis a la carcassa proteica són les regions SAR. S'ha suggerit que aquestes regions tenen un paper global durant la condensació dels cromosomes mitòtics i són necessàries per al manteniment de l'estructura dels cromosomes.[31] Les regions SAR també podrien tenir un paper en l'expressió gènica, en facilitar tant la transició com l'expansió d'una estructura oberta de la cromatina.
Models alternatius de l'estructura cromosòmica
modificaÉs evident que, fins i tot amb els mètodes de fixació més utilitzats,[27] es poden produir canvis significatius en la situació de les proteïnes cromosòmiques, i aquestes dificultats tècniques han estat presents en la major part de les preparacions cromosòmiques utilitzades per fer els estudis estructurals. Per això, és necessari utilitzar mostres vives quan sigui possible, així com enfocaments alternatius que permetin una anàlisi complementària.[32]
Enfocament biofísic
modificaUn mètode alternatiu per l'anàlisi estructural dels cromosomes és el biofísic. Els mesuraments precisos de la rigidesa i l'elasticitat dels cromosomes poden guiar la construcció dels models estructurals. Estudis realitzats en diferents laboratoris indiquen que els cromosomes tenen una elasticitat notable: tant dins de les cèl·lules com en tampons fisiològics, els cromosomes poden estirar-se fins a diverses vegades la seva longitud normal i tornar-hi de nou.[33] Tanmateix, les dades obtingudes per diferents laboratoris són molt variables, probablement a causa de la varietat dels tampons utilitzats pels diferents grups. Un estudi de Poirier i Marko del 2002 va mostrar que l'elasticitat dels cromosomes és molt sensible a la nucleasa.[34] Aquestes dades suggereixen que la integritat mecànica dels cromosomes mitòtics es manté per enllaços entre les fibres cromosòmiques, no per l'existència d'una carcassa proteica. La naturalesa d'aquests enllaços no està clara, però aquest estudi estima la seva freqüència en 10-20 kb com a mínim.
Components bioquímics dels cromosomes
modificaUn mètode convencional i molt potent per entendre una estructura biològica consisteix a establir una llista que n'inclogui tots els components. Els estudis inicials de l'estructura cromosòmica es van enfrontar a molts problemes tècnics per aconseguir aïllar bioquímicament els cromosomes mitòtics de les cèl·lules, encara que mètodes sofisticats permeten l'aïllament dels cromosomes complets i la identificació de la carcassa proteica.[35]
Un mètode alternatiu consisteix en l'ús d'extractes lliures de cèl·lules procedents d'ous d'amfibis. Aquest sistema permet la reconstitució in vitro de cromosomes mitòtics a partir de substrats simples (per exemple, la cromatina d'esperma) en condicions fisiològiques, de manera que els components proteics de les estructures que s'ancoren es poden aïllar per centrifugació en un sol pas i caracteritzar de forma sistemàtica.[36] A més de les histones centrals i una histona de lligament, la fracció aïllada conté topoIIα (CAP-B en aquest estudi), un complex de cinc subunitats denominades condensina (CAP-C,-E,-D2, -G i-H),[36][37] cromocinesina (CAP-D/Klp1)[38] i l'ATPasa remodeladora de cromatina ISWI[38] (CAP-F). Una de les conclusions més importants d'aquests estudis és que les ATPases són components importants dels cromosomes. L'energia d'hidròlisi de l'ATP és utilitzada en molts casos per induir canvis locals o globals en els cromosomes, mentre que en altres casos serveix per suportar el moviment dels cromosomes ancorats als microtúbuls.
Una observació sorprenent fou la identificació de la proteïna titina com un dels components dels cromosomes en embrions de Drosophila.[39] La titina és una proteïna filamentosa gegant (~ 3 MDA) que funciona com un component integral del filament gruixut al sarcòmer de les cèl·lules musculars. S'ha proposat que, en analogia amb la seva funció muscular, la isoforma de la titina que hi ha als cromosomes pot funcionar d'una banda com una "regla molecular" que determina la longitud cromosòmica i de l'altra com una "molla molecular" que dona elasticitat als cromosomes.[40]
ARN
modificaL'ARN sembla tenir un paper en el plegament del cromosoma eucariota, almenys en humans i en Drosophila, on s'han detectat evidències d'aquest paper estructural de l'ARN.[41] No obstant això, cal tenir en compte que la carcassa proteica descrita per Laemmli i col·laboradors (1977) no es veu afectada pel tractament amb ARNasa. Podria ser que les mateixes proteïnes de la carcassa protegissin l'ARN de l'acció de l'ARNasa. En qualsevol cas, cal recordar que l'ADN del cromosoma bacterià també està organitzat en dominis i que l'ARN podria jugar algun paper en el manteniment d'aquesta estructura.
Tipus de cromatina
modificaLa cromatina pot presentar diferents graus d'empaquetament o contracció. Quan els cromosomes es tenyeixen amb substàncies químiques que s'uneixen a l'ADN, apareixen regions densament tenyides i regions menys densament tenyides. La cromatina majoritària, que constitueix la major part del nucli, rep el nom d'eucromatina, i la minoritària s'anomena heterocromatina. Mentre que l'eucromatina representa la fracció que conté la major part dels gens actius, l'heterocromatina intervé en diversos processos nuclears, com la funció centromèrica, el silenciament de gens i l'organització nuclear.
L'heterocromatina pot aparèixer més densament tenyida que l'eucromatina (heteropicnosi positiva) o menys densament tenyida (heteropicnosi negativa). L'aplicació de determinats tractaments experimentals en combinació amb diferents tipus de tinció dels cromosomes pot produir l'aparició de zones heterocromàtiques en els cromosomes de moltes espècies. Aquestes zones heterocromàtiques tenen una distribució característica o patró de bandes típic de cada cromosoma, que permet identificar cromosomes diferents. Aquestes tècniques reben el nom de "tècniques de bandeig cromosòmic" i són molt útils en la identificació individual dels cromosomes i la construcció del cariotip.
Diferències entre eucromatina i heterocromatina
modifica- Diferències genètiques: els experiments de construcció de mapes demostren que la majoria dels gens actius són a l'eucromatina. Als nuclis interfàsics, l'eucromatina es tenyeix menys densament a causa del menor grau d'empaquetament, i en general s'accepta que aquest és l'estat més compatible amb l'activitat gènica i la transcripció. En molts organismes l'heterocromatina flanqueja les regions centromèriques, a vegades també apareix en regions telomèriques, i en alguns casos s'ha detectat l'existència de cromosomes complets heterocromàtics (per exemple, el cromosoma Y de Drosophila melanogaster). S'han detectat molt pocs gens actius a l'heterocromatina.[42] Per exemple, en Drosophila existeixen mutacions letals en gens que es localitzen en regions heterocromàtiques; per tant, aquests gens han de tenir alguna activitat. En qualsevol cas, el percentatge de gens actius localitzats en regions heterocromàtiques és molt baix, comparat amb el de gens actius situats a l'eucromatina. La principal diferència entre eucromatina i heterocromatina rau per tant en l'activitat d'aquests dos tipus de cromatina. Estudis primerencs de l'heterocromatina van conduir al descobriment del fenomen conegut com a "variegació per efecte de la posició" (PEV, per les sigles en anglès),[43] en què si un gen eucromàtic es col·loca a prop o dins d'una regió heterocromàtica, se silencia de manera epigenètica. Aquest procés té implicacions importants en la regulació gènica, l'envelliment i la progressió tumoral.
- Diferències citològiques: estructuralment, als nuclis interfàsics hi ha un major grau d'enrotllament o d'empaquetament a l'heterocromatina que a l'eucromatina.[44] Això es demostra perquè l'heterocromatina té una sensibilitat reduïda al tractament amb nucleases, cosa que reflecteix un posicionament dels nucleosomes a intervals curts i regulars.
- Diferències bioquímiques: l'heterocromatina té modificacions característiques a les histones, com un alt grau de metilació a la lisina 9 de la histona H3 (H3K9) i a la lisina 27 (H3K27), combinat amb una manca d'acetilació. L'heterocromatina també es caracteritza per la presència de la proteïna HP1 (heterochromatin protein 1). A més, l'heterocromatina dels vertebrats i plantes té un elevat grau de metilació a les illes CpG (regions genòmiques riques en dinucleòtids C + G).[45] La metilació d'H3K9 comporta el reclutament de més enzims que transfereixen grups metil a les histones (HMT, histone methyltransferases), mitjançat per l'HP1. S'han descrit dues rutes diferents per dur a terme aquest procés. Una d'aquestes rutes utilitza ARN interferent,[46] mentre que la segona utilitza proteïnes d'unió a ADN que reconeixen seqüències específiques per dirigir les HMT.[46]
- Al·locíclia: l'heterocromatina segueix un cicle de condensació i descondensació diferent del de l'eucromatina. L'heterocromatina pot aparèixer més intensament tenyida que l'eucromatina o menys intensament tenyida, depenent de l'estat cel·lular (al·locíclia). Al seu torn, l'al·locíclia està relacionada amb la replicació de l'ADN. L'heterocromatina es replica més tard que l'eucromatina.
Tipus d'heterocromatina
modificaEs poden distingir dues classes d'heterocromatina:
- Heterocromatina constitutiva: cromatina que apareix sempre més intensament tenyida que l'eucromatina (heteropicnosi positiva), o menys intensament tenyida (heteropicnosi negativa), independentment de l'estat fisiològic o de desenvolupament. L'HP1 és essencial per la formació de l'heterocromatina constitutiva, que es caracteritza per la presència d'H3K9-trimetilada, mitjançada per les HMT denominades Suv39h1 i Suv39h2.[47] En aquest grup s'hi inclou l'ADN satèl·lit de les regions centromèriques i la cromatina dels telòmers.
- Heterocromatina facultativa: cromatina que apareix més intensament tenyida que l'eucromatina, o menys intensament tenyida, depenent de l'estat fisiològic o del moment de desenvolupament. El cromosoma X d'algunes espècies animals, com la llagosta Schistocerca gregari, apareix més intensament tenyit que la resta dels cromosomes durant la diplotena de la profase I de la meiosi. L'heterocromatina facultativa es genera de manera diferent de la constitutiva, possiblement mitjançada per HMT diferents (com G9a, ESET/SETDB1 i/o ErHMTasa1), i sembla que té sobretot H3K9-mono i dimetilada.[45]
En l'espècie humana, tots els cromosomes X que estan en excés d'un apareixen més intensament tenyits que la resta de cromosomes (heteropicnosi positiva) als nuclis de cèl·lules en interfase. Per tant, les dones normals que tenen dos cromosomes X tenen un cromosoma X que apareix més intensament tenyit i que està inactiu. Tanmateix, durant les primeres etapes del desenvolupament embrionari (els 16 primers dies de gestació en l'espècie humana), els dos cromosomes X són actius.
En algunes espècies eucariotes, l'ADN satèl·lit o ADN minoritari que té un contingut en G + C diferent de l'ADN principal o majoritari està constituït per unes seqüències curtes d'ADN que es repeteixen milions de vegades. En concret, en els ratolins s'ha demostrat que l'ADN satèl·lit està situat a la zona centròmerica. Aquest ADN satèl·lit constitueix un exemple d'heterocromatina constitutiva la presència i acció de la qual són constants al cromosoma.[48][49]
Elements diferenciats de l'estructura cromosòmica
modificaL'organització de la cromatina no és uniforme al llarg de l'estructura del cromosoma. De fet, es poden distingir una sèrie d'elements diferenciats: els centròmers (o constriccions primàries), els telòmers (o extrems cromosòmics), les regions organitzadores del nuclèol (NOR) i els cromòmers, tots ells caracteritzats per contenir seqüències específiques d'ADN.[1]
Centròmers
modificaEl centròmer és la constricció primària que, utilitzant tincions tradicionals, apareix menys tenyida que la resta del cromosoma. És la zona per la qual el cromosoma interacciona amb les fibres del fus acromàtic des de la profase fins a l'anafase, tant en mitosi com en meiosi, i és responsable de dur a terme i regular els moviments cromosòmics que tenen lloc durant aquestes fases. Les estructures centromèriques que interaccionen amb les fibres del fus s'anomenen cinetocors. A més, el centròmer contribueix a la nucleació de la cohesió de les cromàtides germanes. A l'estructura del centròmer hi intervenen tant l'ADN centromèric, que es compon fonamentalment d'heterocromatina constitutiva, com proteïnes centromèriques.
En el llevat gemmant Saccharomyces cerevisiae l'ADN centromèric consta únicament de 125 pb i està conservat entre els diferents cromosomes.[50] Malgrat les diferències entre l'ADN centromèric del llevat i dels metazous, el cinetocor s'assembla en ambdós casos sobre nucleosomes centromèrics que contenen una forma especialitzada d'histona H3 (Cse4p en els llevats,[51] o el seu homòleg CENP-A en els metazous).
Telòmers
modificaLa paraula "telòmer" procedeix del grec telos, "final", i meros, "part". Els telòmers són els extrems dels cromosomes. Són regions d'ADN no codificant, altament repetitives, la funció principal de les quals és l'estabilitat estructural dels cromosomes en les cèl·lules eucariotes, la divisió cel·lular i el temps de vida dels llinatges cel·lulars. A més, estan implicats en malalties tan importants com el càncer. En els organismes procariotes, els cromosomes són circulars i no tenen telòmers.[52]
Els telòmers foren descoberts per Hermann Joseph Muller durant la dècada del 1930. Des d'aleshores s'ha avançat molt en el coneixement dels telòmers gràcies a les tècniques de la genètica molecular.
| Grup | Organisme | Seqüència del telòmer (Direcció 5' a 3' fins al final) |
|---|---|---|
| Vertebrats | Humans, ratolí comú, Xenopus | TTAGGG |
| Fongs filamentosos | Neurospora crassa | TTAGGG |
| Floridures del fang | Physarum, Didymium Dictyostelium |
TTAGGG AG(1-8) |
| Protozous cinetoplàstids | Trypanosoma, Crithidia | TTAGGG |
| Protozous ciliats | Tetrahymena, Glaucoma Paramecium Oxytricha, Stylonychia, Euplotes |
TTGGGG TTGGG(T/G) TTTTGGGG |
| Protozous apicomplexos | Plasmodium | TTAGGG(T/C) |
| Plantes superiors | Arabidopsis thaliana | TTTAGGG |
| Algues verdes | Chlamydomonas | TTTTAGGG |
| Insectes | Bombyx mori | TTAGG |
| Ascàrids | Ascaris lumbricoides | TTAGGC |
| Llevats aïllats | Schizosaccharomyces pombe | TTAC (A)(C) G(1-8) |
| Llevats agregats | Saccharomyces cerevisiae Candida glabrata |
TGTGGGTGTGGTG (de còpies d'ARN) or G(2-3)(TG)(1-6)T (consens) |
Regions organitzadores del nuclèol
modificaA més de les constriccions primàries, en alguns cromosomes es pot distingir un altre tipus d'"aprimament" anomenat constricció secundària, que està relacionat normalment amb la presència de seqüències d'ADN ribosòmic. Aquestes regions s'anomenen "regions organitzadores del nuclèol" (o, senzillament, "nors" per l'acrònim en anglès nucleolus organizer regions). Les seqüències d'ADN ribosòmic queden englobades dins dels nuclèols, que romanen adossats a les NOR durant bona part del cicle cel·lular.[1] Els cromosomes amb NOR tenen en molts casos un segment que uneix aquesta regió amb els telòmers, que es denomina «satèl·lit».[53]
Cromòmers
modificaEls cromòmers són "engrossiments" o regions més compactades de l'eucromatina, que es distribueixen de manera més o menys uniforme al llarg dels cromosomes i es poden visualitzar durant les fases de la mitosi o de la meiosi de menor condensació de la cromatina (profase). La seva naturalesa molecular continua sent controvertida, però podrien ser conseqüència d'un cert grau de compartimentalització en la distribució de les seqüències d'ADN i l'organització dels cromosomes. Des de fa anys, el grup de Giorgio Bernardi a Itàlia sosté que hi ha una distribució compartimentalitzada de seqüències relativament grans d'ADN (anomenades «isòcores») al genoma dels vertebrats de sang calenta, de manera que cada isòcoraté un contingut en bases (percentatge de C + G) relativament homogeni però diferent del de les altres.[54][55][56][57] Des de la publicació del primer esborrany del Projecte Genoma Humà, sembla confirmar-se l'existència de cinc isòcores al genoma humà, dues d'elles riques en A i T, i tres riques en G i C. La distribució alternant d'ambdós tipus d'isòcores podria ser l'explicació molecular de l'existència dels cromòmers.[58] [59]
Estructura externa
modificaL'estudi de l'estructura externa dels cromosomes de qualsevol espècie eucariota consisteix a analitzar la forma, mida i nombre dels cromosomes que posseeix. El millor moment per dur a terme aquest estudi sol ser aquell en què els cromosomes han assolit el seu màxim grau de contracció i tenen les seves vores perfectament definides. Aquest moment sol ser durant la metafase mitòtica. L'estudi de l'estructura externa dels cromosomes culmina amb l'obtenció del cariotip.[2] Els cromosomes es poden estudiar en diferents moments segons l'espècie i depenent dels objectius plantejats. Algunes espècies tenen cromosomes que es poden observar amb gran detall edurant la interfase, com és el cas de Drosophila melanogaster, que té cromosomes politènics gegants que s'observen a les glàndules salivals d'aquest insecte, i el de Chironomus tentans, un altre dípter. El cariotip es confecciona, normalment, després d'un adequat pretractament i tinció de les cèl·lules, per fer més visibles els cromosomes individuals. El diagrama simplificat dels cromosomes metafàsics del cariotip s'anomena idiograma, i es construeix amb el nombre genòmic. Per realitzar l'ordenació dels cromosomes tant en cariotips com en idiogrames s'ha de tenir en compte la grandària cromosòmica (ubicats de més gran a més petit, amb el braç curt "bc" o "p" cap amunt i el braç llarg "bl" o "q " cap avall), la posició del centròmer (generalment alineats) i la presència de constriccions secundàries i satèl·lits.[2]
Constància en el nombre
modifica| Especie | Nombre de cromosomes |
|---|---|
| Formiga Myrmecia pilosula, mascle | 1 |
| Formiga Myrmecia pilosula, femella | 2 |
| Mosca de la fruita (Drosophila melanogaster) | 8 |
| Segol (Secale cereale) | 14 |
| Caragol (Helix) | 24 |
| Gat (Felis silvestris catus) | 38 |
| Porc (Sus scrofa) | 40 |
| Ratolí (Mus musculus) | 40 |
| Blat (Triticum aestivum) | 42 |
| Rata (Rattus rattus) | 42 |
| Conill (Oryctolagus cuniculus) | 44 |
| Llebre (Lepus europaeus) | 46 |
| Humà (Homo sapiens sapiens) | 46 |
| Ximpanzé (Pan troglodytes) | 48 |
| Patata, Papa (Solanum tuberosum) | 48 |
| Ovella (Ovis aries) | 54 |
| Vaca (Bos taurus) | 60 |
| Ase (Equus asinus) | 62 |
| Mul (Equus asinus) | 63 (estèril) |
| Cavall (Equus caballus) | 64 |
| Camell ( Camelus bactrianus) | 74 |
| Llama (Lama glama) | 74 |
| Gos (Canis lupus familiaris) | 78 |
| Gallina (Gallus gallus) | 78 |
| Colom Columbia livia | 80 |
| Peix Carassius auratus | 94 |
| Papallona | ~380 |
| Falguera Ophioglussum reticulatum | 1260 |
| Protozou Aulacantha scolymantha | 1600 |
Normalment, les espècies animals i vegetals tenen un nombre de cromosomes constant i determinat que constitueix el seu cariotip (llei de la constància numèrica dels cromosomes), encara que hi ha espècies amb una alta variabilitat cariotípica, no només en nombre sinó en forma i mida dels cromosomes.
El nombre de cromosomes o nombre cromosòmic d'una espècie (o fase vital) diploide s'identifica com 2n, mentre que aquest nombre en una espècie (o fase vital) haploide s'identifica amb la lletra n. En les espècies que tenen un nombre repetit de cromosomes superior a dos complements es parla de poliploïdia, representant el múltiple davant de la lletra n. Així doncs, 3n indicaria un complement cromosòmic triploide, 4n un de tetraploide, etc. Totes aquestes són situacions d'euploïdia. Amb la indicació n es vol expressar el nombre bàsic de cromosomes d'una espècie que tenen individus amb diversos graus de ploïdia o el d'una línia filogenètica a partir de la qual diversos tàxons han assolit situacions aneuploides variades, sent en aquest cas el nombre cromosòmic una variació del nombre original amb augment o disminució del nombre bàsic per pèrdua, fusió o divisió de cromosomes (ex., n+1 o n-1). Un exemple d'aquesta situació infreqüent apareix en els individus de l'espècie humana que tenen la síndrome de Down, situació d'aneuploïdia (2n = 47) per la presència d'un exemplar més del normal del cromosoma 21 (trisomia).
El nombre de cromosomes 2n varia molt d'una espècie a una altra i no existeix relació entre el nombre de cromosomes i la complexitat de l'organisme: hi ha espècies vegetals amb pocs cromosomes, com Haplopappus gracilis (2n = 4), Crepis capillaris (2n = 6) i Secale cereale (2n = 14); espècies vegetals amb bastants cromosomes, com Triticum aestivum (2n = 42) i espècies vegetals amb molts cromosomes, com Ophioglossum petiolatum (n > 500). En els animals passa una cosa semblant, hi ha espècies amb pocs cromosomes com la formiga australiana Myrmecia pilosula, en què els mascles tenen un cromosoma (2n = 1) i les femelles dos cromosomes (2n = 2); espècies amb bastants cromosomes, com els humans (2n = 46) i espècies amb molts cromosomes com el lepidòpter Lysandra atlantica (2n = 434-466). Tampoc no existeix cap relació entre el nombre de cromosomes 2n i la quantitat d'ADN. Un exemple clar d'aquesta situació és el dels cèrvids del gènere Muntiacus, en què hi ha espècies molt similars (anomenades espècies bessones), una amb 2n = 6 (M. muntjak) i una altra amb 2n = 46 (M. reevesi).[61][62]
Cromosomes sexuals
modificaEn molts organismes, un dels parells de cromosomes homòlegs és diferent de la resta: determina el sexe de l'individu. Aquests cromosomes s'anomenen cromosomes sexuals, heterocromosomes o gonosomes, perquè determinen el sexe.
- Sistema de determinació XY: és propi de l'ésser humà i de la majoria dels mamífers però també ho és d'altres organismes, incloent-hi la mosca de la fruita i algunes plantes.[63] El cromosoma Y porta factors que s'encarreguen d'engegar el desenvolupament d'un mascle. El sexe per defecte (en absència d'un cromosoma Y) és femella. Per tant, els mamífers XX són femelles i els XY són mascles. La probabilitat que a la fecundació, en unir-se els gàmetes, resulti una combinació XX (femella) o XY (mascle) és del 50%.
- Sistema de determinació ZW: altres espècies, com els ocells o les papallones tenen el sistema de determinació ZW, on passa el contrari: el sexe masculí és homogamètic (ZZ) i el femení heterogamètic (ZW).[64] Tant en el sistema de determinació del sexe XY com en el ZW, el cromosoma sexual que porta els factors crítics sovint és significativament més petit, i gairebé només porta els gens necessaris per engegar el desenvolupament d'un sexe determinat.[65]
- Sistema de determinació XO: altres espècies (peixos, insectes, amfibis i altres) no tenen un cromosoma determinant del sexe com passa amb l'XY (el cromosoma Y) i el ZW (el cromosoma W), tenen el sistema de determinació XO, XX en les femelles i XO en els mascles on O indica l'absència del cromosoma sexual. Tots els altres cromosomes d'aquests organismes són diploides, però els organismes poden heretar un o dos cromosomes X. En els grills de camp, per exemple, els insectes amb un únic cromosoma X es desenvolupen en mascles, mentre que els que en tenen dos es desenvolupen en femelles.[66] En el nematode Caenorhabditis elegans la majoria de cucs són hermafrodites XX autofertilitzants, però, a vegades, anormalitats en l'herència dels cromosomes donen origen a individus amb només un cromosoma X – aquests individus XO són mascles fèrtils (i la meitat de la seva descendència són mascles).[67]
Forma
modificaLa forma dels cromosomes és constant en totes les cèl·lules somàtiques i és característic de cada espècie. La forma depèn fonamentalment de les constriccions que té el cromosoma i de la seva localització a la cromàtide.
El cromosoma és constituït bàsicament pel centròmer que divideix el cromosoma en un "braç curt" o "braç p" i un "braç llarg" o "braç q". Alguns cromosomes tenen satèl·lits al braç curt.
Segons la posició del centròmer, els cromosomes es classifiquen en:
- Metacèntrics
- El centròmer es localitza al mig del cromosoma i els dos braços tenen la mateixa longitud.
- Submetacèntrics
- La longitud d'un braç del cromosoma és una mica més gran que la de l'altre.
- Acrocèntrics
- Un braç és molt curt (p) i l'altre llarg (q).
- Telocèntrics
- Només s'aprecia un braç del cromosoma, ja que el centròmer està a l'extrem.
Els parells de gonosomes o sexocromosomes es componen de X (submetacèntric mitjà) i Y, considerat acrocèntric sense satèl·lits, encara que en algunes revisions de la literatura se'l considera submetacèntric.
Mida
modificaEls cromosomes pateixen grans variacions en la seva mida al llarg del cicle cel·lular, passant d'estar molt poc compactats (interfase) a estar molt compactats (metafase). Per aquest motiu, els estudis sobre la mida se solen fer durant la metafase mitòtica. A més, cal tenir en compte que els tractaments per tenyir els cromosomes durant les metafases mitòtiques influeixen considerablement en la mida dels cromosomes. En qualsevol cas, en general es pot dir que hi ha espècies eucariotes amb cromosomes grans i espècies amb cromosomes petits. Les monocotiledònies (vegetals) i els amfibis i els ortòpters (animals) tenen cromosomes molt llargs (de 10 a 20 micres). Les dicotiledònies, les algues, els fongs i la majoria d'espècies animals tenen cromosomes petits (longitud inferior a 5 micres). Evidentment, existeixen excepcions dels exemples esmentats. El cromosoma 1 humà té 0,235 pg d'ADN, que equivalen a una longitud total d'ADN doble hèlix de 7,3 cm i durant la metafase mitòtica té una longitud aproximada de 0,001 cm.
Bandeig cromosòmic
modificaEn algunes espècies els parells cromosòmics no es poden diferenciar clarament considerant-ne només els components distintius en sentit longitudinal; en aquests casos cal recórrer a tècniques citològiques especials per la tinció dels cromosomes, que evidencien "bandes" transversals (fosques i clares) al llarg dels mateixos, i que corresponen als diferents tipus de cromatina. En una espècie donada, aquestes variants de la cromatina tenen una mida i una disposició constant. Les tècniques de bandeig cromosòmic més utilitzades són:
- Bandeig C: és relativament senzill, i es basa en l'ús del colorant Giemsa que tenyeix regions amb heterocromatina constitutiva, que en els vegetals apareix principalment en regions telomèriques, mentre que en els animals, apareix en regions centromèriques.
- Bandejos G, R, Q: són tècniques basades en tractaments enzimàtics que posen de manifest diferents patrons de bandes de l'eucromatina al llarg del cromosoma. El material es tenyeix amb colorant Giemsa (G, R) o colorants fluorescents, com la quinacrina (Q). Són les bandes més estudiades en els animals. En els vegetals són molt difícils d'obtenir per l'alt grau d'empaquetament dels cromosomes metafàsics.
- Bandeig NOR: permet identificar la cromatina amb seqüències mitjanament repetides d'ADNr, associada a les regions NOR del cromosoma. El nombre total i la localització de les regions NOR són variables, per la qual cosa, a més de la seva importància funcional té un valor cariotípic.[2]
Cromosomes humans
modificaL'ésser humà té 23 parells de cromosomes a les seves cèl·lules somàtiques: 22 autosòmics i un parell de cromosomes sexuals (dos cromosomes X en el cas de les dones, un dels quals està inactivat, i un cromosoma X i un Y en el cas dels homes). La mida total aproximada del genoma humà és de 3.200 milions de bases d'ADN (3200 Mb), que contenen uns 20.000-25.000 gens.[68] De les 3.200 Mb unes 2.950 corresponen a l'eucromatina i unes 250 a l'heterocromatina. El Projecte Genoma Humà va produir una seqüència de referència del genoma humà eucromàtic, utilitzat a tot el món en les ciències biomèdiques.
La seqüència d'ADN que forma el genoma humà conté codificada la informació necessària per a l'expressió altament coordinada i adaptable a l'ambient del proteoma humà (el conjunt de proteïnes de l'ésser humà). El genoma humà té una densitat de gens molt inferior a la que s'havia predit inicialment, amb només al voltant de l'1,5%[69] de la seva longitud composta per exons codificants de proteïnes. Un 70% està compost d'ADN extragènic i un 30% de seqüències relacionades amb gens. Del total d'ADN extragènic, aproximadament un 70% correspon a repeticions disperses, de manera que, més o menys, la meitat del genoma humà correspon a seqüències repetitives d'ADN. Per la seva banda, del total d'ADN relacionat amb gens s'estima que el 95% correspon a ADN no codificant: pseudogens, fragments de gens, introns i seqüències UTR, entre d'altres.
A la taula següent s'hi llisten els cromosomes humans, el nombre aproximat de gens que té cadascun, la seva mida en parells de bases i la seva morfologia:
| Cromosoma | Gens | Parells de bases | Forma† |
|---|---|---|---|
| 1 | 4.220 | 247.000.000[70] | metacèntric, gran |
| 2 | 2.610 | 242.000.000[71] | submetacèntric, gran |
| 3 | 1.860 | 199.500.000[72] | metacèntric, gran |
| 4 | 450 | 191.000.000[73] | submetacèntric, gran |
| 5 | 620 | 181.000.000[74] | submetacèntric, gran |
| 6 | 2.280 | 171.000.000[75] | submetacèntric, mitjà. |
| 7 | 2.760 | 159.000.000[76] | submetacèntric, mitjà. |
| 8 | 1.290 | 146.000.000[77] | submetacèntric, mitjà. |
| 9 | 1.920 | 140.500.000[78] | submetacèntric, mitjà. |
| 10 | 1.790 | 131.500.000[79] | submetacèntric, mitjà. |
| 11 | 450 | 131.000.000[80] | submetacèntric, mitjà. |
| 12 | 1560 | 132.000.000[81] | submetacèntric, mitjà. |
| 13 | 920 | 114.000.000[82] | acrocèntric, mitjà, amb satèl·lit als seus braços curts. |
| 14 | 1.800 | 106.000.000[83] | acrocèntric, mitjà, amb satèl·lit als seus braços curts |
| 15 | 1120 | 100.000.000[84] | acrocèntric, mitjà, amb satèl·lit als seus braços curts |
| 16 | 1100 | 89.000.000[85] | submetacèntric, petit |
| 17 | 1580 | 79.000.000[86] | submetacèntric, petit |
| 18 | 770 | 76.000.000[87] | submetacèntric, petit |
| 19 | 1860 | 64.000.000[88] | metacèntric, petit |
| 20 | 1010 | 62.000.000[89] | metacèntric, petit |
| 21 | 580 | 47.000.000[90] | acrocèntric, petit |
| 22 | 1820 | 49.500.000[91] | acrocèntric, petit |
| X | 1850 | 155.000.000[92] | acrocèntric, petit |
| Y | 450 | 58.000.000[93] | submetacèntric, petit |
Tècniques d'estudi
modificaÉs possible visualitzar els cromosomes per mitjà de la microscòpia de llum i tincions especials. El procés per obtenir el material cromosòmic es realitza en diversos passos:[94]
- Obtenció de la mostra: es realitza exclusivament a partir de teixits vius que contenen cèl·lules amb nucli. S'empren principalment els glòbuls blancs que hi ha a la sang per la seva fàcil accessibilitat.
- Sembra: es realitza afegint aproximadament un mil·lilitre de sang sencera heparinitzada a un medi de cultiu enriquit amb sèrum fisiològic fetal boví, antibiòtics i mitògens, cosa que estimula el creixement i divisió de les cèl·lules.
- Incubació: es manté a 38° amb una atmosfera de CO₂ al 5% i humitat durant 72 hores.
- Collita: s'afegeix colquicina a la mostra per aturar la mitosi a la metafase, aleshores se centrifuga la barreja per retirar-ne el sobrenadant (sèrum sanguini i medi de cultiu). S'afegeix solució hipotònica de clorur de potassi per trencar les membranes cel·lulars i, finalment, es fan tres rentats amb una solució de metanol i àcid acètic.
- Degoteig: després dels rentats, per mitjà de centrifugació, s'obté un botó cel·lular blanc, que se suspèn a la mateixa solució fixadora de metanol i àcid acètic i es procedeix a gotejar en un portaobjectes a uns quants centímetres, amb l'objectiu de "rebentar" les cèl·lules i obtenir-ne els cromosomes.
- Envelliment: en aquest pas s'espera que la mostra perdi humitat. Es pot aplicar calor al portaobjectes per deshidratar la mostra.
- Tinció: existeixen molts tipus de tincions per observar els cromosomes. La més utilitzada és la tinció amb colorant Giemsa, que es coneix com a tècnica de bandes GTG. En aquest cas s'exposa la mostra del portaobjectes a tripsina, amb l'objectiu de desnaturalitzar algunes de les proteïnes constitutives dels cromosomes. Posteriorment es tenyeixen amb dos colorants, Giemsa i Wright. En alguns laboratoris s'empra un sol colorant, però l'ús d'ambdós millora la qualitat del resultat, ja que facilita l'anàlisi al microscopi pel citogenetista, creant un contrast de color en les bandes que s'han format en emprar la tripsina. Per mitjà d'aquestes bandes es poden distingir les característiques d'un cromosoma i determinar si és normal o té alguna anomalia estructural. Existeixen altres tècniques de tinció, com bandes NOR, ICH, bandes Q, bandes R, tècniques per tenyir centròmer i heterocromatina. Amb aquest tipus de tècniques es pot arribar a realitzar un diagnòstic citogenètic sobre una malaltia cromosòmica.
- Lectura: l'últim pas consisteix a observar com a mínim 20 plaques metafàsiques i formar un cariotip o cariograma, on s'acomoden els cromosomes per grups segons la mida i la localització del centròmer.
Tipus especials
modificaExisteixen alguns tipus de cromosomes presents només en alguns tipus cel·lulars o en poblacions concretes d'una espècie. Entre ells, destaquen els cromosomes politènics, en escombreta, els cromosomes B i els isocromosomes.
Cromosomes politènics
modificaLes cèl·lules de les glàndules salivals dels insectes dípters tenen nuclis que estan en una interfase permanent. Durant el creixement i desenvolupament de les larves d'aquests insectes, la divisió cel·lular s'atura en alguns teixits però les cèl·lules continuen el seu creixement per increment del volum. Aquest procés passa, per exemple, als tubs de Malpighi, les cèl·lules nutrícies dels ovaris, l'epiteli intestinal i les cèl·lules de les glàndules salivals. A les cèl·lules d'aquests teixits, els cromosomes pateixen rondes repetides de duplicacions sense separar-se, procés conegut com a endomitosi. Això porta a la producció de cromosomes constituïts per diversos centenars o milers de brins. Durant aquest procés de politenizació o politènia, els cromosomes incrementen tant la seva longitud com el seu diàmetre. De fet, la longitud dels cromosomes de Drosophila durant una metafase és de l'ordre de 7,5 μm mentre que la llargada total dels cromosomes en un nucli de les glàndules salivals és d'aproximadament 2.000 μm.[53][95]
A més del canvi en la mida, els cromosomes politènics tenen dues altres característiques. En primer lloc, els cromosomes homòlegs estan associats entre si en tota la seva extensió. Aquesta condició, anomenada "aparellament somàtic", és pròpia de la mitosi de la majoria dels dípters.[96] L'altra característica peculiar és que els cromosomes mostren un patró particular del bandeig transversal que consisteix en zones més fosques, anomenades bandes, que s'alternen amb zones clares, anomenades interbandes. Quan s'observen al microscopi òptic s'identifiquen com bandes fosques i clares transversals alternants.[97] Tot i que la majoria de les bandes són contínues a través del cromosoma, d'altres apareixen com una sèrie de punts. Aquest bandeig és reproduïble de nucli a nucli, formant un patró constant de manera que els cromosomes poden ser identificats i manejats en tota la seva longitud. Hi ha aproximadament 5.000 bandes i 5000 interbandes en total al genoma de Drosophila melanogaster. Com que el patró de bandeig que tenen els cromosomes politènics és un reflex constant de les seqüències d'ADN, les bandes serveixen de marcadors per localitzar diverses característiques genètiques (locus dels gens o canvis en el genoma a causa de rearranjaments cromosòmics, com per exemple delecions, duplicacions de bandes i translocacions)[98][99] i s'han utilitzat en diversos estudis genètics i evolutius.[100][101][102][103][104]
En D. melanogaster el patró de bandeig no es distingeix en les regions heterocromàtiques presents en regió centromèrica de tots els seus cromosomes (n=4). Les regions heterocromàtiques estan associades formant un cromocentre. Com que dos membres del complement haploide d'aquesta espècie són metacèntrics (els cromosomes 2 i 3) i dos són acrocèntrics (cromosoma sexual X o Y i el 4), els cromosomes politènics d'aquesta espècie apareixen com a cinc braços desiguals que irradien del cromocentre: un braç corresponent al cromosoma 10, els dos braços del cromosoma 2 i els dos braços del cromosoma 3 (3L i 3R). En alguns casos es pot visualitzar un sisè braç molt petit que representa el cromosoma 4.[53]
Cromosoma en escombreta
modificaEls cromosomes en escombreta (també anomenats cromosomes plumosos), observats per primera vegada per Walther Flemming el 1882 en oòcits d'axolot (Ambystoma mexicanum),[5] són un dels tipus de cromosomes més grans i apareixen als oòcits de la majoria d'animals, llevat dels mamífers. Apareixen durant l'estadi de la meiosi I, denominat diplotè. Després d'aquest període relativament llarg de la meiosi I, els cromosomes en escombreta tornen a compactar-se durant el període de metafase I. Són estructures transitòries, específicament bivalents (és a dir, dos cromosomes aparellats, cadascun dels quals està format per dues cromàtides germanes). Cadascun dels dos cromosomes està constituït per dos llargs brins que formen molts "ruls" o "bucles", com un raspall o escombreta, al llarg de l'eix major del cromosoma. Aquests "ruls" permeten que l'ADN estigui disponible pel procés de transcripció durant la maduració de l'ovòcit.[106][107] De fet, la presència de cromosomes en escombreta en una cèl·lula és un indicador que està produint-se la transcripció de l'ARN missatger.[108][109][110] El nom de "cromosomes en escombreta" (lampbrush chromosomes) fou encunyat el 1892 per J. Rückert,[111] que va assimilar la forma d'aquests cromosomes a un raspall del segle xix, bastant semblant al que actualment es denomina «netejatubs».[108]
Cromosomes B
modificaLa majoria d'organismes són habitualment molt poc tolerants a l'addició o pèrdua de material cromosòmic, fins i tot en quantitats ínfimes. Així, alteracions cromosòmiques com les delecions, duplicacions i aneuploïdies (l'excés o defecte respecte al nombre cromosòmic normal en una espècie donada) provoquen en l'individu afectat des de malformacions fins a inviabilitat en diferents nivells del desenvolupament. No obstant això, una excepció a aquest fet en moltes espècies animals i vegetals consisteix en l'existència de cromosomes supernumeraris o cromosomes B. La distinció entre els cromosomes B i els del complement normal (cromosomes A) fou feta per primera vegada per Randolph el 1928.[112] En general, els cromosomes accessoris tenen les característiques següents:[113]
- No són indispensables per la vida normal dels seus portadors.
- No són homòlegs de cap dels cromosomes A, dels que probablement procedeixen.
- En general tenen sistemes d'herència irregulars i no mendelians.
- Morfològicament, solen ser més petits que els cromosomes del complement normal, heterocromàtics i alocíclics.
- Quant a la seva distribució, els cromosomes B varien en freqüència.
- Dins de poblacions de la mateixa espècie (per exemple, en el saltamartí Myrmeleotettix maculatus només s'han trobat cromosomes B a la part sud de la Gran Bretanya; no apareixen ni en altres poblacions del país ni a les poblacions de països continentals propers com França o Bèlgica.)[114]
- Dins d'individus de la mateixa població.
- Dins de cèl·lules del mateix organisme (per exemple, en Aegilops mutica i Aegilops speltoides) els B només estan presents en algunes parts aèries de les plantes, com hipocotils i àpexs, i no a les arrels.[115]
- En general no tenen gens majors,[116] no tenen efectes qualitatius sobre el fenotip[114] i són nocius pels individus que els porten en nombre elevat.[113]
Tanmateix, el terme "cromosoma B" integra un conjunt heterogeni de cromosomes, que varien tant en el seu comportament com en la seva forma i mida, per la qual cosa les generalitzacions s'han de fer amb precaució.
Mutacions
modificaL'ADN muta i pateix canvis, un fet bastant comú en les poblacions naturals. Aquests canvis poden afectar segments de cromosomes, cromosomes sencers o tot el genoma. En el cas dels organismes amb reproducció asexual, aquestes mutacions són les úniques causants de l'evolució; en els organismes amb reproducció sexual també interfereix i de forma principal la recombinació genètica. La majoria de mutacions cromosòmiques es produeixen accidentalment a l'òvul, l'espermatozoide o en el moment de la fecundació, pel que poden ser heretables. Per tant, l'anomalia està present a cada cèl·lula del cos. Algunes anomalies, però, poden passar després de la concepció, cosa que resulta en mosaïcisme (quan algunes cèl·lules tenen l'anomalia i altres no). Les anomalies cromosòmiques poden ser heretades dels progenitors o poden ser de novo. Per aquest motiu sovint es realitzen estudis dels pares quan un infant té una anomalia.
Mutacions estructurals
modificaSón aquelles mutacions que afecten l'estructura dels cromosomes, la seva forma i mida.
- Variació en el nombre de gens
- Deleció: pèrdua d'un segment cromosòmic. Es pot tractar d'una deleció cromosòmica intestinal, si és un fragment interior del cromosoma, o una deleció cromosòmica terminal, si la pèrdua és en un extrem. En un organisme homozigòtic una deleció sol ser mortal, mentre que en un organisme heterozigòtic es necessita una pèrdua massiva de gens per provocar-la, amb un desequilibri genètic.[117] Algunes anomalies genètiques són causades per una deleció en una regió cromosòmica específica, com per exemple la síndrome del miol o la síndrome de Wolf-Hirschhorn.,[118] síndrome del miol (braç curt del cromosoma 5),[119] síndrome de Prader-Willi (braç llarg del cromosoma 15), síndrome d'Angelman (regió concreta del cromosoma 15), síndrome de Di George (extrem distal del braç llarg del cromosoma 22), etc.
- Duplicació: multiplicació d'un segment cromosòmic. Normalment, quan es dona és per l'entrecreuament desigual de la meiosi i rarament una duplicació té efectes nocius per l'organisme. La duplicació té un paper molt important en l'evolució, ja que, tot i ser una repetició, aporta nova informació genètica.[120][121] Aquesta importància rau en el fet que els individus normalment tenen dues còpies d'un mateix gen. Si hi ha una mutació d'aquest gen, pot haver-hi efectes negatius, però si l'individu té més de dues còpies, podrà seguir manifestant un fenotip aparentment normal. Les duplicacions no solen tenir una manifestació fenotípica observable a primera vista, però sí mitjançant anàlisis citogenètiques i moleculars.[122]
- Variació en la disposició dels gens
- Inversió: alteració d'un grup de gens al cromosoma. La inversió s'origina pel trencament del cromosoma en dos punts diferents i la posterior unió en punts invertits. És una inversió pericèntrica quan la regió invertida comprèn el centròmer i paracèntrica quan no. En una inversió pericèntrica s'altera la morfologia del cromosoma, i per tant sol ser molt més greu. Normalment les inversions no comporten alteracions fenotípiques.[123] Les inversions poden produir gàmetes desequilibrats durant la meiosi.[124]
- Translocació: Intercanvi de gens entre cromosomes no homòlegs. Les translocacions equilibrades són aquelles en què l'individu en qüestió té un fenotip normal, tot i que sol ser estèril o presentar problemes de fertilitat. Les translocacions desequilibrades són més greus i tenen variacions genotípiques.[125][126] Les translocacions tenen lloc amb una freqüència d'1 de cada 1.000 nounats. En aquest tipus de mutació cromosòmica no hi ha guany ni pèrdua de material, i per això no solen ser patològiques. Sí que ho poden ser si els punts de ruptura interrompen alguna seqüència codificant. Són translocacions recíproques quan dos cromosomes s'intercanvien gens i no recíproca quan només és un cromosoma que rep i un que dona.
- Isocromosoma: Un isocromosoma és un cromosoma metacèntric anormal originat durant la meiosi o mitosi quan la divisió del centròmer es produeix pel pla horitzontal en lloc del vertical. A conseqüència d'això, un dels braços del cromosoma original es perd i els braços de l'isocroma resultat són genèticament idèntics entre si però en sentit invers.[2] En els humans, els isocromosomes s'associen a certes malalties. Així, per exemple, apareixen en algunes nenes que tenen la síndrome de Turner, en els pacients amb la síndrome de Pallister-Killian, i alguns tumors. L'isocromosoma "17q" (o sigui, l'isocromosoma format per dos braços llargs del cromosoma 17 i que ha perdut el braç curt) i l'isocromosoma "14q" estan associats a certs tipus de leucèmia.[127][128] A més, els individus portadors d'isocromosomes poden tenir descendents amb un nombre de cromosomes superior al normal.[129]
Mutacions numèriques
modifica- Variació en el nombre de conjunts cromosòmics.
- Haploïdia: dotació cromosòmica d'un sol conjunt cromosòmic (n). En els animals, el més freqüent és una dotació diploide (2n), tret de les cèl·lules sexuals que són n.[130][131]
- Poliploïdia: Increment del nombre de cromosomes característic del complement diploide,[132][133] per exemple, la no disjunció dels cromosomes en la meiosi porta a l'aparició d'individus 4n, que estan aïllats reproductivament de l'espècie, tot i poder reproduir-se sexualment. La poliploïdia es produeix per irregularitats de la meiosi a la primera divisió (profase), quan els cromosomes homòlegs s'aparellen per formar tètrades, i no se separen durant l'anafase I; això origina una cèl·lula amb tot el complement cromosòmic i una altra sense cromosomes, on la primera passa per la segona divisió meiòtica i produeix gàmetes diploides. Per tant, si aquest gàmeta s'uneix amb un altre de normal, produirà un zigot triploide (estèril). Pel seu origen, els poliploides poden ser:
- Autopoliploides: derivats d'un sol diploide per multiplicació dels seus cromosomes
- Alopoliploides: derivats d'un híbrid entre dues diploides
- Variació en el nombre de cromosomes
- Aneuploïdia: Dotació cromosòmica anormal, no hi ha una dotació haploide o un múltiple d'ella.[134] L'aneuploïdia apareix freqüentment en cèl·lules canceroses. En els animals només poden ser viables les monosomies i les trisomies, car que les nul·lisomies són letals. Quan hi ha un endarreriment de la meiosi es perden cromosomes (nul·lisomia i monosomia), i quan no hi ha una disminució meiòtica es dona un augment dels cromosomes (trisomia, tetrasomia, etc.) Els diferents tipus de mutacions aneuploides més freqüents són:[135]
- Nulisomia: falta un grup de cromosomes homòlegs, (2n-2)
- Monosomia: falta un cromosoma complet, (2n-1)
- Trisomia: hi ha tres cromosomes iguals, (2n+1)
- Tetrasomia: hi ha quatre cromosomes iguals, (2n+2)
- Aneuploïdia: Dotació cromosòmica anormal, no hi ha una dotació haploide o un múltiple d'ella.[134] L'aneuploïdia apareix freqüentment en cèl·lules canceroses. En els animals només poden ser viables les monosomies i les trisomies, car que les nul·lisomies són letals. Quan hi ha un endarreriment de la meiosi es perden cromosomes (nul·lisomia i monosomia), i quan no hi ha una disminució meiòtica es dona un augment dels cromosomes (trisomia, tetrasomia, etc.) Els diferents tipus de mutacions aneuploides més freqüents són:[135]
Mutacions amb importància clínica
modificaLes aberracions cromosòmiques o un nombre incorrecte de cromosomes poden causar síndromes clíniques amb efectes potencialment greus. No sempre és possible classificar aquestes patologies segons la mutació o aberració cromosòmica; per exemple, la síndrome de Down és causada en la majoria de casos per un cromosoma 21 addicional complet, però en aproximadament un 3% dels casos la causa són translocacions, en què una part del cromosoma 21 està fusionada amb un altre cromosoma. En aquest cas, només aquesta part està triplicada. Les síndromes següents són explicades més detalladament al seu article corresponent, per la qual cosa aquí només se'n fa una presentació general.
Trisomies autosòmiques
modificaEn els individus que neixen vius, només es coneixen trisomies lliures dels autosomes en els cromosomes 21, 18 i 13, tots tres cromosomes pobres en gens. Això porta a la conclusió que les trisomies lliures en la resta d'autosomes no són compatibles amb la vida. N'és una excepció el cromosoma 8, del qual es coneixen mutacions en individus vius; tanmateix, la trisomia 8 té símptomes molt greus i sovint causa una mort prematura poc després del naixement.
- Síndrome de Down o "Trisomia 21". Incidència: 1 de cada 600-800 nounats. Els símptomes més importants són les cardiopaties i les deficiències intel·lectuals. Mentre que antigament la majora d'afectats morien de malalties infeccioses durant la infància, actualment la seva esperança de vida és de més de 60 anys.
- Síndrome d'Edwards o "Trisomia 18". Incidència: 1 de cada 2.500 nounats. Múltiples insuficiències, especialment cardiopaties i insuficiències renals. Greus deficiències intel·lectuals (incapacitat de parlar), els malalts rarament assoleixen l'edat adulta.
- Síndrome de Patau o "Trisomia 13". Incidència: 1 de cada 6.000 nounats. Són símptomes freqüents les cardiopaties, llaví leporí, polidactília i greus deficiències intel·lectuals. Els malalts rarament assoleixen l'edat adulta.
- Trisomia 8. Són símptomes freqüents línies marcades a les mans i els peus, defectes de les vèrtebres, defectes del tub neural (sovint espina bífida oberta) i gegantisme.
Anormalitats en el nombre de cromosomes sexuals
modifica- Síndrome de Turner, (45,X). Manca el segon cromosoma sexual. Incidència: 1 de cada 3.000 nounats. Les dones amb aquesta síndrome tenen característiques sexuals femenines subdesenvolupades, una alçada petita, tenen arrels capil·lars profundes, ulls poc habituals i artells agrandits, un pit excavat i són majoritàriament estèrils. La intel·ligència és normal, però a vegades s'observen dificultats en la coordinació espacial i el raonament matemàtic.
- Síndrome de triple X, (47,XXX). La síndrome de triple X és l'aberració cromosòmica clínicament menys important. Es creu que la majoria de casos ni tan sols són diagnosticats. La intel·ligència sol ser inferior a la dels germans. La fecunditat pot estar una mica reduïda. Els descendents tenen una taxa d'aberracions cromosòmiques ínfimament superior.
- 48,XXXX i 49,XXXXX. Amb un nombre superior de cromosomes X es redueix la intel·ligència i la fecunditat.
- Síndrome de Klinefelter, (gairebé sempre 47,XXY; rarament 48,XXXY o 49,XXXXY). 1 de cada 1.000 nounats homes. Els homes amb aquesta síndrome sovint són estèrils, grans, tenen extremitats particularment llargues, una tendència a un augment dels pits (pseudoginecomàstia) i menys pèl corporal. El quocient intel·lectual sol ser uns 10 punts inferior al dels germans.
- Síndrome de XYY (47,XYY). Els homes amb aquesta síndrome no solen tenir particularitats fenotípiques i se'ls sol diagnosticar per casualitat. La longevitat no es veu escurçada, la fecunditat és gairebé normal, de mitjana mesuren uns 10 més que els seus germans i la seva intel·ligència és lleugerament inferior. Ocasionalment, aquesta aberració està associada amb trastorns com ara la criptorquídia.
- Polisomia Y d'alt grau: 48,XXYY Els homes són similars als homes XYY, però estèrils i una tendència a una intel·ligència minvada. Aquesta última està més marcada en els homes 48,XYYY i els 49,XYYYY, més rars. També es donen insuficiències d'òrgans.
Cromosomes marcadors
modificaEls cromosomes marcadors són cromosomes anormals sense parts identificables, que existeixen juntament amb els normals. Es componen del mateix material que els cromosomes normals, però són majoritàriament petits, de manera que és impossible la identificació per bandatge G. Se'ls pot estudiar amb hibridació fluorescent in situ.
Deleció d'autosomes
modificaNo existeixen les monosomies d'autosomes, car les anomalies que hi estan associades no són compatibles amb la vida. Tanmateix, existeix una varietat de delecions diferents de parts d'un autosoma, que només es coneixen en pocs casos clínics. Per consegüent, aquesta llista no és completa i només inclou els exemples més coneguts.
- Tot i que no fa gaire que se la coneix, la deleció de l'extrem del braç curt del cromosoma 1 és probablement la deleció més comuna (1 de cada 5.000-10.000 nounats).
- La síndrome del miol de gat és causada per la deleció de l'extrem del braç curt del cromosoma 5. El 1963 fou la primera deleció autosòmica a ser descrita. La incidència és d'un per cada 50.000 nounats. A la infància primerenca, els infants emeten un xiscle agut que recorda als miols dels gats i que es deu a una malformació de la laringe. Tenen ulls molt separats l'un de l'altre (hipertelorisme), un cap i unes mandíbules petits (microcefàlia) i tenen deficiències intel·lectuals. Els òrgans interns no solen estar afectats, de manera que les probabilitats de supervivència són elevades.
- La síndrome de Wolf-Hirschhorn es deu a la deleció de l'extrem curt del cromosoma 4. La incidència és d'un per cada 50.000 nounats. Els afectats solen patir greus deficiències cognitives i tenen trastorns de creixement.
- La síndrome de De Grouchy es dona en dues variants, cadascuna provocada per la deleció d'un braç diferent del cromosoma 18.
En són més exemples la síndrome de Williams (7q11.23) i la síndrome de Smith-Magenis (17p11.2 – incidència d'un de cada 15.000-25.000 nounats).
Són un cas particular les delecions de la regió 15q11.2-q12. Aquesta regió està sotmesa a una regulació epigenètica, la impressió genètica. Depenent de si aquesta regió ha sigut heretada del pare o la mare, determinats gens són actius o inactius. Normalment, les dues opcions estan disponibles. Tanmateix, si manca una de les dues, es provoquen trastorns, que difereixen segons si està afectada la part heretada de la mare (síndrome d'Angelman) o la part heretada del pare (síndrome de Prader Willi).
Quan hi ha sospita que una dona embarassades pot transmetre una anormalitat cromosòmica al seu fill s'usa el codi 0.35.1 de la CIM-10.
Equivalents en procariotes
modificaEls procariotes tenen quelcom de similar a un únic "cromosoma" circular, més conegut com a ADN circular, tot i que existeixen algunes variants d'aquesta regla.[136] El cromosoma bacterià, més pròpiament conegut com a genòfor, pot tenir una mida des de 160.000 parells de bases (com en l'endosimbiont Carsonella ruddii,[137] fins a 12.200.000 parells de bases en el bacteri del sòl Sorangium cellulosum.[138] El genòfor manca de cromatina. Aquesta és la principal diferència respecte als cromosomes dels organismes procarites i el principal motiu pel qual no es considera com a cromosoma en el sentit estricte.[139]
Els eubacteris normalment tenen un sol punt en el seu cromosoma des del qual s'inicia la duplicació, mentre que alguns arqueus tenen múltiples llocs d'inici de la duplicació.[140] D'altra banda, els gens dels procariotes estan organitzats en operons i no contenen introns.
Els procariotes no tenen un nucli autèntic, sinó que el seu ADN està organitzat en una estructura anomenada nucleoide.[141] El nucleoide és una estructura distintiva i ocupa una regió definida a la cèl·lula bacteriana. Aquesta estructura és molt dinàmica i és mantinguda i remodelada per l'acció de proteïnes similars a les histones, que s'associen al cromosoma bacterià.[142] En els arqueus, l'ADN del cromosoma encara està més organitzat, amb l'ADN empaquetat dins d'estructures similars als nucleosomes eucariotes.[143] [144]
Cromosomes artificials
modificaEls cromosomes artificials són cromosomes que han estat manipulats per mitjà d'eines d'enginyeria genètica perquè presentin estructures precises que en permetin la integració, permanència i duplicació en determinats organismes.[145] El cromosoma artificial del llevat, o YAC (acrònim anglès de yeast artificial chromosome), és un tipus de vector de clonació d'alta capacitat que és, de fet, el de major capacitat (200 kb a 3.000 kb). Fou descrit per primera vegada el 1983 per Murray i Szostack.[146] És un vector que imita les característiques d'un cromosoma normal d'un llevat, ja que porta un centròmer i els telòmers terminals. Això permet clonar (és a dir, multiplicar) en els llevats seqüències d'ADN de fins a un milió de parells de bases o més, en comportar-se com un cromosoma propi del llevat. Són utilitzats en la construcció de genoteques genòmiques, sent molt estès el seu ús en els primers anys del Projecte Genoma Humà.[147] Tanmateix, són més inestables que altres vectors, tals com els BAC (acrònim anglès de 'bacterial artificial chromosome, "cromosoma artificial bacterià"), que han acabat imposant-se.[148] Aquests últims també són vectors de clonació usats per clonar fragments d'ADN de 100 a 300 kb de grandària en el bacteri Escherichia coli. La seva estructura és anàloga a la del plasmidi factor-F trobat de manera natural en aquesta espècie bacteriana.[1]
Vegeu també
modificaReferències
modifica- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Piqueras, J.F., Fernández Peralta, A.M., Hernández, J.S., González Aguilera, J.J. 2002. Genética. Ariel Ciencia, España, 474 pàg. ISBN 84-344-8056-5
- ↑ 2,0 2,1 2,2 2,3 2,4 Facultat de Ciències Agropecuaries. Universidad Nacional de Córdoba (Argentina). Genética. Capítulo 2. «Forma y tamaño cromosómico. Cariotipo.». Arxivat de l'original el 2009-05-21. [Consulta: 26 juliol 2009].
- ↑ Nägeli, Carl, "Memoir on the nuclei, formation, and growth of vegetable cells (A. Henfrey, trans.), a C. and J. Adlard, eds, Reports and Papers on Botany. Londres: The Ray Society, 1846.
- ↑ Daintith, John, et al., (eds), Biographical Encyclopedia of Scientists, second edition. Bristol, UK: Institute of Physics Publishing, 1994.
- ↑ 5,0 5,1 Flemming, W. 1882. Zell-substanz, Kern und Zelltheilung ('Citoplasma, nucli i divisió cel·lular').
- ↑ Olins, D.E.; Olins, A.L. «Chromatin history: our view from the bridge». Nature Reviews Molecular Cell Biology, 4, 10, 2003, pàg. 809–813. Arxivat de l'original el 2006-09-10 [Consulta: 3 juliol 2009]. Arxivat 2006-09-10 a Wayback Machine.
- ↑ Crow, E.W. «100 Years Ago: Walter Sutton and the Chromosome Theory of Heredity». Genetics, 160, 1, 2002, pàg. 1–4.
- ↑ Satzinger, Helga «Theodor and Marcella Boveri: chromosomes and cytoplasm in heredity and development». Nature Reviews Genetics, 9, 3, 2008, pàg. 231. DOI: 10.1038/nrg2311.
- ↑ Morgan, Thomas Hunt, "Chromosomes and Heredity," The American Naturalist, 44(524):449-496, 1910.
- ↑ Gonzalo Claros, M. Historia de la Biologìa (V): La naturaleza química del DNA (hasta el primer tercio del siglo XX) Arxivat 2010-09-22 a Wayback Machine.. Edició per Internet de la revista Encuentros en la Biología, editada a la Facultat de Ciències de la Universidad de Málaga. ISSN 1134-8496
- ↑ Levene P. «The structure of yeast nucleic acid». J Biol Chem, 40, 2, 1919, pàg. 415–24. Arxivat de l'original el 2009-06-29 [Consulta: 6 juliol 2009]. Arxivat 2009-06-29 a Wayback Machine.
- ↑ 12,0 12,1 Kornberg, R.D.; Lorch, Y. «Twenty-Five Years of the Nucleosome, Fundamental Particle of the Eukaryote Chromosome». Cell, 98, 1999, pàg. 285–294. Arxivat de l'original el 2010-06-22. DOI: 10.1016/S0092-8674(00)81958-3 [Consulta: 7 juliol 2009]. Arxivat 2010-06-22 a Wayback Machine.
- ↑ 13,0 13,1 Facultat de Cièncias Veterinàries. Universitat Nacional de la Plata. MORFOLOGÍA CROMOSÓMICA - CARIOTIPO Arxivat 2008-12-02 a Wayback Machine.
- ↑ Isenberg, I «Histones». Annual Reviews in Biochemistry, 48, 1, 1979, pàg. 159–191. DOI: 10.1146/annurev.bi.48.070179.001111.
- ↑ Grunstein, M. «Histone Function in Transcription». Annual Reviews in Cell Biology, 6, 1, 1990, pàg. 643–676. DOI: 10.1146/annurev.cb.06.110190.003235.
- ↑ Kedes, L.H «Histone Genes and Histone Messengers». Annual Reviews in Biochemistry, 48, 1, 1979, pàg. 837–870. DOI: 10.1146/annurev.bi.48.070179.004201.
- ↑ 17,0 17,1 Klug A, Rhodes D, Smith J, Finch JT, Thomas JO. A low resolution structure for the histone core of the nucleosome. Nature. 1980 Oct 9;287(5782):509–516.
- ↑ 18,0 18,1 Klug, A. & L C Lutter.1981. The helical periodicity of DNA on the nucleosome Arxivat 2013-08-01 at Archive.is. Nucleic Acids Res. September 11; 9(17): 4267–4283.
- ↑ 19,0 19,1 19,2 Hock, R.; Furusawa, T.; Ueda, T.; Bustin, M. «HMG chromosomal proteins in development and disease». Trends in Cell Biology, 17, 2, 2007, pàg. 72–79. Arxivat de l'original el 2013-08-01. DOI: 10.1016/j.tcb.2006.12.001 [Consulta: 13 juliol 2009].
- ↑ 20,0 20,1 20,2 Bustin, M. «Còpia arxivada». Molecular and Cellular Biology, 19, 8, 1999, pàg. 5237–5246. Arxivat de l'original el 2009-02-10 [Consulta: 13 juliol 2009].
- ↑ Kornberg, Roger D. «Chromatin Structure: A Repeating Unit of Histones and DNA». Science, 184, 4139, 1974, pàg. 868–871. DOI: 10.1126/science.184.4139.868. PMID: 4825889.
- ↑ 22,0 22,1 Woodcock, C.L.; Dimitrov, S. «Higher-order structure of chromatin and chromosomes». Current Opinion in Genetics & Development, 11, 2, 2001, pàg. 130–135.
- ↑ Li, Gang; Sudlow, Gail; Belmont, Andrew S. The Journal of Cell Biology, 140, 5, 1998, pàg. 975–989. DOI: 10.1083/jcb.140.5.975. PMID: 9490713.
- ↑ 24,0 24,1 Paulson, J.R.; Laemmli, U.K. «The structure of histone-depleted metaphase chromosomes». Cell, 12, 3, 1977, pàg. 817–28. DOI: 10.1016/0092-8674(77)90280-X.
- ↑ Earnshaw, W.C.; Halligan, B.; Cooke, C.A.; Heck, M.M.; Liu, L.F. «Topoisomerase II is a structural component of mitotic chromosome scaffolds». The Journal of Cell Biology, 100, 5, 1985, pàg. 1706–1715. DOI: 10.1083/jcb.100.5.1706. PMID: 2985625.
- ↑ Gasser, S.M.; Laroche, T.; Falquet, J.; Tour, E.; Laemmli, U.K. «Metaphase chromosome structureInvolvement of topoisomerase II». J. Mol. Biol, 188, 1986, pàg. 613–629. DOI: 10.1016/S0022-2836(86)80010-9.
- ↑ 27,0 27,1 27,2 Christensen, Morten O.; Larsen, Morten K.; Barthelmes, Hans Ullrich; Hock, Robert «Dynamics of human DNA topoisomerases II{alpha} and II{beta} in living cells». The Journal of Cell Biology, 157, 1, 2002, p. 31–44. DOI: 10.1083/jcb.200112023.
- ↑ Maeshima, K.; Laemmli, U.K. «A Two-Step Scaffolding Model for Mitotic Chromosome Assembly». Developmental Cell, 4, 4, 2003, p. 467–480. DOI: 10.1016/S1534-5807(03)00092-3.
- ↑ Tavormina, Penny A.; Come, Marie-George; Hudson, Joanna R.; Mo, Yin-Yuan «Rapid exchange of mammalian topoisomerase II{alpha} at kinetochores and chromosome arms in mitosis». The Journal of Cell Biology, 158, 1, 2002, p. 23–29. DOI: 10.1083/jcb.200202053.
- ↑ Mirkovitch, J.; Mirault, M.E.; Laemmli, U.K. «Organization of the higher-order chromatin loop: specific DNA attachment sites on nuclear scaffold». Cell, 39, 1, 1984, p. 223–32. DOI: 10.1016/0092-8674(84)90208-3.
- ↑ Hart, C.M.; Laemmli, U.K. «Facilitation of chromatin dynamics by SARs». Current Opinion in Genetics & Development, 8, 5, 1998, p. 519–525. DOI: 10.1016/S0959-437X(98)80005-1.
- ↑ Swedlow, J.R.; Hirano, T. «The Making of the Mitotic Chromosome: Modern Insights into Classical Questions». Molecular Cell, 11, 3, 2003, p. 557–569. DOI: 10.1016/S1097-2765(03)00103-5.
- ↑ Poirier, M.G.; Eroglu, S.; Marko, J.F. «The Bending Rigidity of Mitotic Chromosomes». Molecular Biology of the Cell, 2002, p. 10804011.
- ↑ Poirier, M.G.; Marko, J.F. «Mitotic chromosomes are chromatin networks without a mechanically contiguous protein scaffold». Proc. Natl. Acad. Sci. USA, 99, 2002, p. 15393-15397.
- ↑ Lewis, C.D.; Laemmli, U.K. «Higher order metaphase chromosome structure: evidence for metalloprotein interactions». Cell, 29, 1, 1982, p. 171–81. DOI: 10.1016/0092-8674(82)90101-5.
- ↑ 36,0 36,1 Hirano, T.; Mitchison, T.J. «A heterodimeric coiled-coil protein required for mitotic chromosome condensation in vitro». Cell, 79, 3, 1994, p. 449–58. DOI: 10.1016/0092-8674(94)90254-2.
- ↑ Hirano, M.; Kobayashi, R. «Condensins, Chromosome Condensation Protein Complexes Containing Xcap-c, Xcap-e and a Xenopus …». Cell (Cambridge), 89, 4, 1997, p. 511–521.
- ↑ 38,0 38,1 Vernos, I.; Raats, J.; Hirano, T.; Heasman, J. «Xklp 1, A Chromosomal Xenopus Kinesin-like Protein Essential for Spindle Organization and Chromosome…». Cell(Cambridge), 81, 1, 1995, p. 117–127.
- ↑ MacHado, C.; Sunkel, C.E.; Andrew, D.J. «Human Autoantibodies Reveal Titin as a Chromosomal Protein». The Journal of Cell Biology, 141, 2, 1998, p. 321–333.
- ↑ MacHado, C.; Andrew, D.J. «D-Titin a Giant Protein with Dual Roles in Chromosomes and Muscles». The Journal of Cell Biology, 151, 3, 2000, p. 639–652.
- ↑ Clemson, C.M. «…X chromosome at interphase: evidence for a novel RNA involved in nuclear/chromosome structure». The Journal of Cell Biology, 132, 3, 1996, p. 259–275.
- ↑ Elgin, S.C.R. «Heterochromatin and gene regulation in Drosophila». Current Opinion in Genetics & Development, 6, 2, 1996, p. 193–202.
- ↑ Lewis, E.B. «The phenomenon of position effect». Adv Genet, 3, 1950, p. 73–115. DOI: 10.1016/S0065-2660(08)60083-8.
- ↑ Heitz, E. «Das heterochromatin der Moose». Jahrb. Wiss. Botanik, 69, 1928, p. 762–818.
- ↑ 45,0 45,1 Grewal, S.I.S.; Rice, J.C. «Regulation of heterochromatin by histone methylation and small RNAs». Current Opinion in Cell Biology, 16, 3, 2004, p. 230–238. DOI: 10.1016/j.ceb.2004.04.002.
- ↑ 46,0 46,1 Volpe, Thomas A.; Kidner, Catherine; Hall, Ira M.; Teng, Grace «Regulation of Heterochromatic Silencing and Histone H3 Lysine-9 Methylation by RNAi». Science, 297, 5588, 2002, p. 1833–1837. DOI: 10.1126/science.1074973.
- ↑ Lachner, M.; O'Sullivan, R.J.; Jenuwein, T. «An epigenetic road map for histone lysine methilation». Journal of Cell Science, 116, 2003, p. 2117-2124. DOI: 10.1242/10.1242/jcs.00493.
- ↑ Hennig, W. «Heterochromatin». Chromosoma, 108, 1, 1999, p. 1–9. DOI: 10.1007/s004120050346.
- ↑ Craig, J.M. «Heterochromatin-many flavours, common themes». BioEssays, 27, 1, 2005, p. 17–28. DOI: 10.1002/bies.20145.
- ↑ Fitzgerald-hayes, M.; Clarke, L.; Carbon, J. «Nucleotide sequence comparisons and functional analysis of yeast centromere DNAs». Cell, 29, 1, 1982, p. 235–44. DOI: 10.1016/0092-8674(82)90108-8.
- ↑ Meluh, P.B.; Yang, P.; Glowczewski, L.; Koshland, D. «Cse 4 P is a Component of the Core Centromere of Saccharomyces Cerevisiae». Cell(Cambridge), 94, 5, 1998, p. 607–613.
- ↑ Kurenova, E.V.; Mason, J.M. «Telomere functions. A review». Biochemistry (Mosc), 62, 11, 1997, p. 1242–53.
- ↑ 53,0 53,1 53,2 Panzera, F., Ruben Pérez y Yanina Panzera. Identificación cromosómica, cariotipo Arxivat 2012-03-02 a Wayback Machine.. Facultat de Cièncias Veterinàries, Universitat Nacional de La Plata.
- ↑ Saccone, S.; Federico, C.; Andreozzi, L.; D'Antoni, S. «Chromosome structure». Chromosome Research, 10, 1, 2002, p. 1–50.
- ↑ Bernardi, G. «The Isochore Organization of the Human Genome». Annual Reviews in Genetics, 23, 1, 1989, p. 637–659. DOI: 10.1146/annurev.ge.23.120189.003225.
- ↑ Saccone, S.; Bernardi, G. «Human chromosomal banding by in situ hybridization of isochores». Methods in Cell Science, 23, 1, 2001, p. 7–15. DOI: 10.1023/A:1013173011458.
- ↑ Bernardi, G. «The Human Genome: Organization and Evolutionary History». Annual Reviews in Genetics, 29, 1, 1995, p. 445–476. DOI: 10.1146/annurev.ge.29.120195.002305.
- ↑ Costantini, M.; Clay, O.; Auletta, F.; Bernardi, G. «An isochore map of human chromosomes». Genome Research, 16, 4, 2006, p. 536–541. DOI: 10.1101/gr.4910606.
- ↑ Bernardi, G. «Isochores and the evolutionary genomics of vertebrates». Gene, 241, 1, 2000, p. 3–17. DOI: 10.1016/S0378-1119(99)00485-0.
- ↑ Arnold J. Bendich, Karl Drlica. 2000. Prokaryotic and eukaryotic chromosomes: what's the difference?. BioEssays 22: 481-486.
- ↑ Doris H. Wurster and Kurt Benirschke.1970. Indian Momtjac, Muntiacus muntiak: A Deer with a Low Diploid Chromosome Number. Science 12 June 1970: Vol. 168. no. 3937, pàg. 1364 - 1366.
- ↑ McClintock, B. (1984). The significance of responses of the genome to challenge. Science 226, 792-801.
- ↑ Dellaporta SL, Calderon-Urrea A «Sex Determination in Flowering Plants». The Plant Cell, 5, 1993, pàg. 1241–1251. DOI: 10.2307/3869777.
- ↑ Smith CA, Katza M, Sinclair AH «DMRT1 Is Upregulated in the Gonads During Female-to-Male Sex Reversal in ZW Chicken Embryos». Biology of Reproduction, 68, 2003, pàg. 560–570. DOI: 10.1095/biolreprod.102.007294. PMID: 12533420.
- ↑ «Evolution of the Y Chromosome». Annenberg Media. Arxivat de l'original el 2004-11-04. [Consulta: 1r abril 2008].
- ↑ Yoshimura A «Karyotypes of two American field crickets: Gryllus rubens and Gryllus sp. (Orthoptera: Gryllidae)». Entomological Science, 8, 3, 2005, pàg. 219–222. DOI: 10.1111/j.1479-8298.2005.00118.x.
- ↑ Riddle DL, Blumenthal T, Meyer BJ, Priess JR. C. Elegans II. Cold Spring Harbor Laboratory Press, 1997. ISBN 0-87969-532-3.9.II. Sexual Dimorphism
- ↑ International Human Genome Sequencing Consortium. Finishing the euchromatic sequence of the human genome.. 431, 2004, p. 931-45. PMID: 15496913. «Enllaç».
- ↑ International Human Genome Sequencing Consortium. Initial sequencing and analysis of the human genome.. 409, 2001, p. 860-921. PMID: 11237011. «Enllaç».
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 1. Consulta el 12 de desembre del 2008. [1]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 2. Consulta el 12 de desembre del 2008. [2]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 3. Consulta el 12 de desembre del 2008. [3]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 4. Consulta el 12 de desembre del 2008. [4]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 5. Consulta el 12 de desembre del 2008. [5]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 6. Consulta el 12 de desembre del 2008. [6]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 7. Consulta el 12 de desembre del 2008. [7]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 8. Consulta el 12 de desembre del 2008. [8]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 9. Consulta el 12 de desembre del 2008. [9]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 10. Consulta el 12 de desembre del 2008. [10]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 11. Consulta el 12 de desembre del 2008. [11]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 12. Consulta el 12 de desembre del 2008. [12]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 13. Consulta el 12 de desembre del 2008. [13]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 14. Consulta el 12 de desembre del 2008. [14]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 15. Consulta el 12 de desembre del 2008. [15]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 16. Consulta l'11 de gener del 2009. [16]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 17. Consulta l'11 de gener del 2009. [17]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 18. Consulta l'11 de gener del 2009. [18]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 19. Consulta l'11 de gener del 2009. [19]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 20. Consulta l'11 de gener del 2009. [20]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 21. Consulta l'11 de gener del 2009. [21]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 22. Consulta l'11 de gener del 2009. [22]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome X. Consulta l'11 de gener del 2009. [23]
- ↑ Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome Y. Consulta l'11 de gener del 2009. [24]
- ↑ César Paz y Miño. 1999. Citogenética humana: manual de prácticas. Práctica 5: CULTIVO Y PREPARACION DE LINFOCITOS PARA ANALISIS CROMOSOMICO. Laboratorio de Genética Molecular y Citogenética Humana, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales y Facultad de Medicina. PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR. (castellà)
- ↑ Ashburner, M. «Function and structure of polytene chromosomes during insect development». Adv Insect Physiol, 7, 1, 1970, p. 3S4.
- ↑ Rudkin, G.T. «Replication in polytene chromosomes». Results Probl Cell Differ, 4, 1972, p. 59–85.
- ↑ G. «The Relationship Between Genes and Polytene Chromosome Bands». Annual Reviews in Genetics, 8, 1, 1974, p. 51–62. DOI: 10.1146/annurev.ge.08.120174.000411.
- ↑ Lewis, E.B. «The Theory and Application of a New Method of Detecting Chromosomal Rearrangements in Drosophila». The American Naturalist, 88, 841, 1954, p. 225. DOI: 10.1086/281833.
- ↑ C.A. «The Genetic Organization of Chromosomes». Annual Reviews in Genetics, 5, 1, 1971, p. 237–256. DOI: 10.1146/annurev.ge.05.120171.001321.
- ↑ Gunderina, L.I.; Kiknadze, I.I.; Istomina, A.G.; Gusev, V.D. «Divergence of the polytene chromosome banding sequences as a reflection of evolutionary». Russian Journal of Genetics, 41, 2, 2005, p. 130–137. DOI: 10.1007/s11177-005-0036-6.
- ↑ Gunderina, L. I. (2005) Divergence patterns of banding sequences in different polytene chromosome arms reflect relatively independent evolution of different genome components. Russian Journal of Genetics 41(4)
- ↑ Coluzzi, Mario; Sabatini, Adriana; Della Torre, Alessandra; Di Deco, Maria Angela «A Polytene Chromosome Analysis of the Anopheles gambiae Species Complex». Science, 298, 5597, 2002, p. 1415–1418. DOI: 10.1126/science.1077769.
- ↑ Moltó, M.D.; Frutos, R.; Martinez-sebastián, M.J. «The banding pattern of polytene chromosomes of Drosophila guanche compared with that of D. subobscura». Genetica, 75, 1, 1987, p. 55–70. DOI: 10.1007/BF00056033.
- ↑ Zhao, J.T.; Frommer, M.; Sved, J.A.; Zacharopoulou, A. «Mitotic and polytene chromosome analyses in the Queensland fruit fly, Bactrocera tryoni (Diptera: Tephritidae)». Genome, 41, 1998, p. 510–526. DOI: 10.1139/gen-41-4-510.
- ↑ Oscar Hertwig, 1906: Lehrbuch der Entwicklungsgeschichte des Menschen und der Wirbeltiere. Achte Auflage.
- ↑ Izawa, M.; Allfrey, V.G.; Mirsky, A.E. «The Relationship between RNA Synthesis and Loop Structure in Lampbrush Chromosomes». Proceedings of the National Academy of Sciences, 49, 4, 1963, p. 544–551.
- ↑ Callan, H.G. «The Nature of Lampbrush Chromosomes». Int Rev Cytol, 15, 1963, p. 1–34. DOI: 10.1016/S0074-7696(08)61114-6.
- ↑ 108,0 108,1 Macgregor, H. Lampbrush chromosomes . School of Biosciences, Universitat d'Exeter.
- ↑ Callan, H.G. «Lampbrush chromosomes». Mol Biol Biochem Biophys, 36, 1986, p. 1–252.
- ↑ Gall, J.G.; Murphy, C.; Callan, H.G.; Wu, Z.A. «Lampbrush chromosomes». Methods Cell Biol, 36, 1991, p. 149–66. DOI: 10.1016/S0091-679X(08)60276-9.
- ↑ Rückert, J. 1892. Zur Entwicklungsgeschichte des Ovarialeies bei Selachiern. Anat Anz 7: 107-158.
- ↑ Randolph, L.F.. Chromosome numbers in Zea Mays. 117, 1928. 44.
- ↑ 113,0 113,1 Jones, R.N.; Rees, H. B chromosomes, 1982.
- ↑ 114,0 114,1 Hewitt, G.M.; East, T.M. «Effects of B chromosomes on development in grasshopper embryos». Heredity, 41, 1978, p. 347–356. DOI: 10.1038/hdy.1978.105.
- ↑ Cebriá A., Navarro M.L., Puertas M.J.. Genetic control of B-chromosome transmission in Aegilops speltoides (Poaceae). 81, 1994. 1502-1511.
- ↑ Fox, D.P.; Hewitt, G.M.; Hall, D.J. «DNA replication and RNA transcription of euchromatic and heterochromatic chromosome regions during…». Chromosoma, 45, 1, 1974, p. 43–62. DOI: 10.1007/BF00283829.
- ↑ Deleció(castellà)
- ↑ Diccionari mèdic - Deleció(català)
- ↑ Lewis R. 2005. Human Genetics: Concepts and Applications, 6a Ed. McGraw Hill, Nova York.
- ↑ Diccionari mèdic - Duplicació Arxivat 2008-09-15 a Wayback Machine.(català)
- ↑ Taylor JS, Raes J «Duplication and divergence: the evolution of new genes and old ideas». Annu. Rev. Genet., 38, 2004, pàg. 615–43. DOI: 10.1146/annurev.genet.38.072902.092831. PMID: 15568988.
- ↑ Duplicació(castellà)
- ↑ Diccionari mèdic - inversió(català)
- ↑ Inversions(castellà)
- ↑ Diccionari mèdic - translocació(català)
- ↑ Translocacions(castellà)
- ↑ Hernandez-boluda, J.C.; Cervantes, F.; Costa, D.; Carrio, A. «. Chronic myeloid leukemia with isochromosome 17q: report of 12 cases and review of the literature». Leuk Lymphoma, 38, 1-2, 2000, p. 83–90.
- ↑ Liu, H.W.; Lie, K.W.; Chan, L.C. «Isochromosome 14 q and leukemia with dysplastic features». Cancer genetics and cytogenetics, 64, 1, 1992, p. 97–98. DOI: 10.1016/0165-4608(92)90333-4.
- ↑ Kleczkowska, A.; Fryns, J.P.; Buttiens, M.; Bisschop, F. «Trisomy (18q) and tetrasomy (18p) resulting from isochromosome formation». Clinical Genetics, 30, 6, 1986, p. 503–508. DOI: 10.1111/j.1399-0004.1986.tb01918.x.
- ↑ Haploïdia(castellà)
- ↑ Diccionari mèdic - Haploïdia(català)
- ↑ Poliploïdia(castellà)
- ↑ Diccionari mèdic - Poliploïdia(català)
- ↑ Diccionari mèdic - Aneuploïdia(català)
- ↑ Aneuploïdia(castellà)
- ↑ Thanbichler M, Shapiro L. Chromosome organization and segregation in bacteria. 156, 2006, p. 292–303. DOI 10.1016/j.jsb.2006.05.007.
- ↑ Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar H, Moran N, Hattori M. The 160-kilobase genome of the bacterial endosymbiont Carsonella. 314, 2006, p. 267. DOI 10.1126/science.1134196.
- ↑ Pradella S, Hans A, Spröer C, Reichenbach H, Gerth K, Beyer S. Characterisation, genome size and genetic manipulation of the myxobacterium Sorangium cellulosum So ce56. 178, 2002, p. 484–92. DOI 10.1007/s00203-002-0479-2.
- ↑ Ris, H. (1961). Ultrastructure and molecular organization of genetic systems. Can. J. Genet. Cytol. 3, 95-120.
- ↑ Kelman LM, Kelman Z. Multiple origins of replication in archaea. 12, 2004, p. 399–401. DOI 10.1016/j.tim.2004.07.001.
- ↑ Thanbichler M, Wang SC, Shapiro L. The bacterial nucleoid: a highly organized and dynamic structure. 96, 2005, p. 506–21. DOI 10.1002/jcb.20519.
- ↑ Sandman K, Pereira SL, Reeve JN. Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome. 54, 1998, p. 1350–64. DOI 10.1007/s000180050259.
- ↑ Sandman K, Reeve JN «Structure and functional relationships of archaeal and eukaryal histones and nucleosomes». Arch. Microbiol., 173, 3, 2000, pàg. 165–9. DOI: 10.1007/s002039900122. PMID: 10763747.
- ↑ Pereira SL, Grayling RA, Lurz R, Reeve JN «Archaeal nucleosomes». Proc. Natl. Acad. Sci. U.S.A., 94, 23, 1997, pàg. 12633–7. DOI: 10.1073/pnas.94.23.12633. PMID: 9356501.
- ↑ Basu, J. and Huntington F. Willard. Artificial and engineered chromosomes: non-integrating vectors for gene therapy. Trends in Molecular Medicine, Volume 11, Issue 5, May 2005, 251-258.
- ↑ Murray AW, Szostak JW (1983): Construction of artificial chromosomes in yeast, Nature 305, 2049-2054.
- ↑ Larin Z, Monaco AP, Lehrach H (1991): Yeast artificial chromosome libraries containing large inserts from mouse and human DNA, Proceedings of the National Academy of Sciences (USA) 88, 4123-4127.
- ↑ Bellanné-Chantelot C et al. (1992): Mapping the whole human genome by fingerprinting yeast artificial chromosomes, Cell 70, 1059-1068
Bibliografia
modifica- Adolph, K. (ed.) 1988. Chromosomes and chromatin, Vols. 1-3, Boca Raton, FL; CRC Press.
- Hsu, T.C. 1979. Human and mammalian cytogenetics: an historical perspective. Nova York, Springer Verlag.
- Stewart, A. 1990. The functional organization of chromosomes and the nucleus, a special issue. Trends Genet. 6:377-379
- Price, C.M. 1992. Centromeres and telomeres. Curr. Opin. Cell Biol. 4: 379-384.
- Gall, J.G. 1981. Chromosome structure and the C-value paradox. J. Cell Biol. 91:3-14
- Blackburn, E.H., Szostak, J.W. 1984. The molecular structure of centromeres and telomeres. Annu. Rev. Biochem. 53: 163-194.
Enllaços externs
modifica- Kimballs Chromosome pages (anglès)
- Chromosome News from Genome News Network (anglès)
- Chromosome Abnormalities at AtlasGeneticsOncology (anglès)
- Home reference on Chromosomes de la Biblioteca Nacional de Medicina U.S. (anglès)
{1} {2} {3} {4} {5} {6} {7} {8} {9} {10} {11} {12} {13} {14} {15} {16} {17} {18} {19} {20} {21} {22} {X} {Y} |