Níquel
El níquel és l'element químic de símbol Ni i nombre atòmic 28.[3] Forma part del grup 10 de la taula periòdica dels elements.
| Níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
28Ni
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||
Brillant, metàl·lic, platejat amb un matís daurat  Línies espectrals del níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Níquel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 10, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 58,6934(4)(2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 3d8 o [Ar] 4s1 3d9 (vegeu text) 2, 8, 16, 2 o bé 2, 8, 17, 1 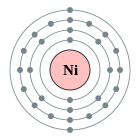
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
8,908 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
7,81 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.728 K, 1.455 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.186 K, 2.913 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 17,48 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 377,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 26,07 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 4[1], 3, 2, 1[2], -1 (òxid bàsic feble) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,91 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 737,1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.753,0 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.395 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 124±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Ferromagnètic | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 69,3 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 90,9 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 13,4 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (t. a.) 4.900 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 4,0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Història
modificaL'ús del níquel es remunta aproximadament al segle iv aC, generalment junt amb el coure, ja que apareix ben sovint en els minerals d'aquest metall; bronzes originaris de l'actual Síria tenen continguts de níquel superiors al 2 %. Manuscrits xinesos suggereixen que el «coure blanc» s'utilitzava a Orient cap a 1400-1700 aC, no obstant la facilitat de confondre les menes de níquel amb les d'argent indueix a pensar que en realitat l'ús del níquel fou posterior, cap al segle iv aC.
Els minerals que contenen níquel, com la niquelina, s'havien emprat, en confondre'ls amb mineral de cobalt, per a pintar el vidre.[4] A Alemanya, a les muntanyes Metal·líferes els miners anomenaven despectivament Kupfernickel ‘coure de níquel’ a les menes que semblaven de coure, però de les quals no s'obtenia aquest metall.[5]
El 1751 el químic suec Axel Fredrik Cronstedt (1722-1765), intentant determinar quins metalls d'interès contenien les menes de les mines sueques de Los (a l'època, Loos), Hälsingland, estudià el mineral niquelina NiAs i obtingué un metall que donava un color groc en dissoldre'l en àcid nítric. Inicialment, pensà que havia trobat coure, i hi afegí ferro esperant que la reacció prevista donaria coure vermell, però això no succeí. Després de molts experiments aconseguí aïllar el metall.[6]
Cronstedt publicà el seu descobriment a les Transaccions de la Reial Acadèmia Sueca de les Ciències (Kungliga Svenska Vetenskapsakademiens Handlingar) el 1751 i el 1754.[7] Anomenà el nou element nickel, abreviació del suec kopparnickel, traduït de l'alemany Kupfernickel, compost de Kupfer ‘coure’ i Nickel ‘gnom de les mines’, diminutiu de Nikolaus (relacionat amb sant Nicolau i els costums relacionats amb la seva festivitat a Alemanya).[8][9] Molts científics reconegueren el descobriment del nou element, però d'altres mantenien que el níquel era una barreja de cobalt, ferro, arsènic i coure. Tots aquests dubtes s'esvaïren el 1775 quan el suec Torbern Olof Bergman (1735-1784) demostrà que les barreges d'aquest elements, en qualsevol proporció, no presentaven les propietats del níquel.[6]
Abundància i obtenció
modificaS'estima que el níquel és present a l'escorça terrestre en una proporció d'entre el 0,01 i el 0,02 %[10] o 84 ppm (g/t),[11] essent el 22è[10] o 23è[11] element més abundant. Hom suposa que és molt més abundant al nucli de la Terra, que estaria compost fonamentalment de ferro i níquel.[10] El níquel també apareix en forma de metall en alguns dels meteorits que cauen a la Terra, junt amb el ferro, formant aliatges com la kamacita o la taenita.
Les menes més habituals entre les que contenen níquel són la pentlandita (Ni,Fe)9S8, una pirita magnètica amb més del 5 % de níquel anomenada pirrotina Fe1–xS i la garnierita (Ni,Mg)6(OH)8Si4O10. Altres minerals serien la gersdorffita NiAsS, la annabergita Ni₃(AsO4)2•8H2O, la niquelina NiAs o la nepouïta Ni3Si2O5(OH)4.[10][11]
La producció mundial de níquel el 2023 fou de 3,6 milions de tones, essent els principals productors: Indonèsia (1,8 milions de tones), les Filipines (400 000 t), Nova Caledònia (230 000 t), Rússia (200 000 t), el Canadà (180 000 t), Austràlia (160 000 t) i la Xina (110 000 t). Les reserves mundials conegudes superen les 130 milions de tones, que es troben majoritàriament a Indonèsia (55 milions de tones), Austràlia (24 milions de tones), el Brasil (16 milions de tones), Rússia (8,3 milions de tones) i Nova Caledònia (7,1 milions de tones).[12]
Característiques principals
modificaPropietat físiques
modificaÉs un metall de transició de color blanc platejat, amb un punt de fusió de 1 455 °C, un punt d'ebullició de 2 730 °C i una densitat de 8,912 g/cm³. conductor de l'electricitat i de la calor, és dúctil i mal·leable pel que es pot laminar, polir i forjar fàcilment, i presenta cert ferromagnetisme.
Propietats químiques
modificaEl seu estat d'oxidació més normal és +2. Pot presentar-ne altres, s'han observat estats d'oxidació 0, +1 i +3 en complexos, però no en són gens característics.
El níquel metall no reacciona amb l'aire en condicions ambientals, però finament dividit hi reacciona fàcilment i en aquesta forma pot ser pirofòric. A temperatures més altes, la reacció entre el níquel metall i l'oxigen sembla que no es completa, però dona una mica d'òxid de níquel(II) NiO. Tampoc reacciona amb l'aigua en condicions habituals.[13]
El níquel metall reacciona amb el fluor F2 lentament, per la qual cosa s'empra en recipients per contenir-lo. Els altres halògens si que reaccionen donant els corresponents halurs de níquel(II):[13]
El níquel metall no reacciona amb hidròxids i es dissol lentament en àcid sulfúric diluït per formar solucions que contenen l'ió Ni(II) aigua juntament amb el gas hidrogen H2. A la pràctica, el Ni(II) està present com a ió complex [Ni(OH2)6]2+.[13]
Isòtops
modificaEn la naturalesa es troben cinc isòtops estables: Ni-58, Ni-60, Ni-61, Ni-62 i Ni-64, sent el més lleuger el més abundant (68,077 %), el segueix el Ni-60 (26,223 %), el Ni-62 (3,635 %), el Ni-61 (1,140 %) i, finalment el Ni-64 (0,926 %).[14]
S'han caracteritzat a més vint-i-sis isòtops radioactius dels que els més estables són el Ni-59, el Ni-63 i el Ni-56 amb períodes de semidesintegració de 76 000 anys, 100,1 anys i 6,077 dies respectivament. Els altres radioisòtops, amb nombres màssics des de 48 a 78, tenen períodes de semidesintegració inferiors a 60 hores i la majoria no arriben els 30 segons. El níquel té a més un estat metaestable.[14]
El Ni-56 es produeix en grans quantitats en supernoves de tipus II corresponent la forma de la corba de llum a la desintegració del Ni-56 en Co-56 i aquest en Fe-56. El Ni-59 és un isòtop de llarga vida obtingut per cosmogènesi. Aquest isòtop ha trobat diverses aplicacions en la datació radiomètrica de meteorits i en la determinació de l'abundància de pols extraterrestre en gels i sediments. El Ni-60 és fill del Fe-60 (període de semidesintegració d'1,5 milions d'anys) la persistència del qual en el sistema solar en concentracions prou altes ha pogut causar variacions observables en la composició isotòpica del Ni-60, d'aquesta manera, l'anàlisi de l'abundància de Ni-60 en materials extraterrestres pot proporcionar informació sobre l'origen del sistema solar i la seua història primordial.
Aplicacions
modificaIndústria metal·lúrgica
modificaMajoritàriament, el níquel es destina a la fabricació d'acers inoxidables austenítics (amb més d'un 7 % de níquel). També són important altres aliatges, les més importants són a continuació:
Aliatges amb coure
modificaEl níquel proporciona a l'aliatge amb coure, anomena cuproníquel i que generalment conté menys del 50 % de níquel i petites quantitats de ferro (0,5-0,6 %) i de manganès (0,3-1 %), una millor resistència a la corrosió marina, a la contaminació biològica i una millor ductilitat. S'usa àmpliament tant en aplicacions marines com en canalitzacions, en la fabricació de revestiments de plataformes i cascs dels vaixells, en gàbies per als peixos utilitzades en aqüicultura i també en bescanviadors de calor i condensadors.
El monel és un aliatge constituït per níquel (66-68 %), coure (27-30 %) i ferro (1,5-3 %), de color blanc, d'una densitat de 8,82 g/cm³ i amb un punt de fusió de 1 360 °C. Té una gran resistència a la tracció, un bon allargament i resisteix remarcablement l'acció corrosiva de l'aigua de mar, del vapor d'aigua i dels àcids (excepte el nítric). L'addició d'alumini, Al, o silici, Si, permet de millorar-ne les característiques mecàniques. És utilitzat en la fabricació de tubs de condensador, hèlices, paletes de turbina, aparells químics, instal·lacions sanitàries i de la indústria alimentària, etc.[16]
Aliatges amb crom
modificaÉs el principal component dels aliatges inconel, nom d'un grup d'uns vint-i-cinc aliatges, de níquel (50-72 %), crom (14-23 %) i altres metalls (coure, manganès i molibdè, entre d'altres). La combinació de níquel i crom proveeix resistència tant a solucions corrosives reductores com oxidants. El níquel i el crom actuen també en conjunt per resistir l'oxidació, carburització i altres formes de deteriorament a altes temperatures. Aquests aliatges no es tornen trencadisses a temperatures criogèniques, tenen bona resistència a la tracció i a la fatiga a temperatures moderades, i presenten excel·lents propietats de resistència al flux i trencament a altes temperatures.[17]
El nicrom és un metall obtingut com un aliatge de níquel, crom i ferro. Amb aquest material es poden fer cables que dissipen una gran quantitat de calor, procés que és aprofitat, per exemple, per les torradores de pa (per assecar l'aigua de les llesques de pa) i per a la pasteurització. Es fon a 500 °C, depenent de la concentració relativa dels seus components.
Aliatges amb ferro
modificaSupermalloy és el nom d'un aliatge compost per nickel (75 %), ferro (20 %) i molibdè (5 %). Es tracta d'un material magnètic del tipus tou (és a dir, de baixa coercitivitat). La resistivitat d'aquest aliatge és de 0,6 Ω·mm²/m. Té una permeabilitat magnètica extremadament alta (aproximadament 800 000 N/A²) i una baixa coercitivitat.
El permaloy és un aliatge de ferro i níquel d'elevada permeabilitat magnètica i feble histèresi magnètica, que és emprat en la fabricació de cables submarins, de nuclis de bobina, d'elements de màquines elèctriques sotmesos a l'acció de camps magnètics alterns, etc.
Aliatges amb alumini
modificaL'alumel és un aliatge constituït pel 94%, aproximadament, de níquel i de petites quantitats ben controlades de silici, alumini i manganès. És molt resistent a la corrosió en medi oxidant, àdhuc per damunt de 1 000 °C. És emprat principalment com a element negatiu de termoparells. La seva resistivitat elèctrica és 0,294 μΩ·m i la seva conductivitat tèrmica 30 W/m/K.
Alnico és un grup d'aliatges de ferro amb quantitats variables (8-12 %) d'alumini, de níquel (14-28 %) i de cobalt (5-24 %).[18] Alguns contenen, a més, petites quantitats de coure i de titani. Segons la seva composició hom distingeix uns dotze tipus d'alnico. Tots ells són caracteritzats per llurs propietats ferromagnètiques i usats en la fabricació d'imants permanents.[19]
Aliatges amb titani
modificaEl nitinol és un metall format per l'aliatge de níquel i titani en quasi la mateixa proporció (per exemple el nitinol 60 té un 60 % de níquel), i presenta unes propietats estranyes respecte als altres aliatges, ja que és capaç de recuperar de manera «intel·ligent» la forma original després d'haver estat deformat, sempre que s'escalfi a la temperatura de transformació.[20][21] Per les seves propietats de material superelàstic, s'han desenvolupat dispositius d'aplicació en medicina, com cilindres - malles autoexpansibles per mantenir la permeabilitat de vasos sanguinis (stents), o dispositius per a oclusió de defectes cardíacs. També s'empren en elements que han de recuperar la seva forma original després d'una severa deformació, com muntures d'ulleres per a nens o antenes de telèfons mòbils (ja en desús). La recuperació de la forma original es pot emprar per a la generació de moviment o per a la fabricació d'acoblaments en conduccions espacials (conduccions en la indústria aeronàutica o conduccions submarines).
Indústria de bateries
modificaLa primera bateria que emprà níquel fou la de níquel i ferro inventada el 1899 per Thomas Alva Edison. És una bateria molt robusta que tolera la sobrecàrrega, sobredescàrrega i el curtcircuit,[22] però és de fabricació cara i altres tipus de bateries l'han desplaçat.[23] Tanmateix en aplicacions especials el seu ús s'ha incrementat.[24][25][26]
L'hidròxid de níquel s'utilitzava en la producció de bateries recarregables de níquel i cadmi (Ni-Cd), però eren pesants i no podien emmagatzemar tanta energia, com les piles de níquel i hidrur metàl·lic (Ni-MH), que les han substituït perquè són més barates i menys contaminants. El níquel s'utilitza en la fabricació de bateries de sodi i níquel (bateries zebra) que treballen a altes temperatures.
Un acumulador de níquel hidrogen (NIH₂ o Ni-H₂) és una font de potència electroquímica recarregable obtinguda a partir de níquel i hidrogen.[27] Aquest tipus de bateria utilitza cel d'hidrogen pressuritzat a més de 82,7 bar.[28]
Altres camps
modificaEs fa servir en recobriments electrolítics antioxidants (niquelat).
Rol biològic
modificaMoltes hidrogenases contenen níquel, especialment aquelles la funció de les quals és oxidar l'hidrogen. Sembla que el níquel pateix canvis en el seu estat d'oxidació el que indicaria que el nucli de níquel és la part activa de l'enzim.
El níquel està també present en l'enzim metil com a reductasa i en bacteris metanògens.
Precaucions
modifica| Aquest article o secció no cita les fonts o necessita més referències per a la seva verificabilitat. |
L'exposició al níquel metall i els seus compostos solubles no ha de superar els 0,05 mg/cm³ mesurats en nivells de níquel equivalent per a una exposició laboral de 8 hores diàries i 40 setmanals. Els vapors i la pols de sulfur de níquel se sospita que poden ser cancerígens.
El carbonil de níquel (Ni(CO)₄), generat durant el procés d'obtenció del metall, és un gas extremadament tòxic.
Les persones sensibilitzades poden manifestar al·lèrgies al níquel. La quantitat de níquel admissible en productes que puguin entrar en contacte amb la pell està regulada per la Unió Europea; tot i així, la revista Nature va publicar el 2002 un article en què investigadors afirmaven haver trobat en monedes d'1 i 2 euros nivells superiors als permesos, es creu que a causa d'una reacció galvànica.
Referències
modifica- ↑ M. Carnes et al. «A Stable Tetraalkyl Complex of Nickel(IV)». Angewandte Chemie International Edition, 48, 2009, pàg. 3384. DOI: 10.1002/anie.200804435.
- ↑ S. Pfirrmann et al. «A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps». Angewandte Chemie International Edition, 48, 2009, pàg. 3357. DOI: 10.1002/anie.200805862.
- ↑ «níquel». Gran Enciclopèdia Catalana. Grup Enciclopèdia Catalana. [Consulta: 7 agost 2021].
- ↑ Enghag, 2008, p. 689.
- ↑ Trifonov, 1982, p. 62.
- ↑ 6,0 6,1 Trifonov, 1982, p. 63.
- ↑ Enghag, 2008, p. 690.
- ↑ «níquel». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana. [Consulta: 15 febrer 2024].
- ↑ Harper, Douglas. «nickel» (en anglès). Online Etymology Dictionary. [Consulta: 16 febrer 2024].
- ↑ 10,0 10,1 10,2 10,3 Newton, 2010, p. 377.
- ↑ 11,0 11,1 11,2 Enghag, 2008, p. 685.
- ↑ «NICKEL» (PDF) (en anglès). Mineral Commodity Summaries. U.S. Geological Survey, gener 2024, pàg. 2.
- ↑ 13,0 13,1 13,2 Winter, Mark. «Nickel. Reactions of elements». WebElements. The University of Sheffield and WebElements Ltd. [Consulta: 19 febrer 2024].
- ↑ 14,0 14,1 Gray, Theodore. «Technical data for the element Nickel». Periodictable.com. [Consulta: 16 febrer 2024].
- ↑ Callister, William D.; Rethwisch, David G. Materials science and engineering: an introduction: SI Version. 10th edition, global edition. Hoboken: Wiley, 2020. ISBN 978-1-119-45391-8.
- ↑ «Níquel». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «Inconel ALEACIONES NIQUEL-CROMO». American Special Metalls. [Consulta: 3 gener 2012].
- ↑ Dawes, Chester L. Electricidad industrial (en castellà). vol.2. Reverte, 1982, p. 172. ISBN 8429130209.
- ↑ «Níquel». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Materials and Coatings for Medical Devices: Cardiovascular. ASM International, 1 gener 2009, p. 95–. ISBN 978-1-61503-135-1.
- ↑ Alan R. Pelton. SMST 2003: Proceedings of the International Conference on Shape Memory and Superelastic Technologies. ASM International, 2004, p. 183–. ISBN 978-1-61503-107-8.
- ↑ David Linden, Thomas B. Reddy (ed). Handbook Of Batteries 3rd Edition, McGraw-Hill, Nova York, 2002 ISBN 0-07-135978-8, Chapter 25
- ↑ Ian Soutar. «Nickel Iron Battery Association HomePage», 01-07-2010. [Consulta: 30 octubre 2011].
- ↑ Mother Earth News Issue #62 - March/April 1980
- ↑ «nickel iron battery information». [Consulta: 24 desembre 2017].
- ↑ Home Power Magazine Issue #80 December 2000/Jan 2001
- ↑ «Un model simplificat d'una bateria níquel-hidrogen». Arxivat de l'original el 2016-03-03. [Consulta: 28 juliol 2010].
- ↑ «Instruccions d'emmagatzematge i maneig de bateries aeroespaciles de níquel-hidrogen». Arxivat de l'original el 2012-10-23. [Consulta: 28 juliol 2010].
Bibliografia
modifica- Enghag, Per. Encyclopedia of the Elements (en anglès). WILEY-VCH Verlag GmbH, 2008, p. 76. ISBN 3-527-30666-8.
- Newton, David E. Chemical Elements (en anglès). Segona. Gale, 2010. ISBN 9781414476087.
- Trifonov, D. N.; Trifonov, V. D. Chemical Elements - How They Were Discovered (en anglès). Moscou: MIR, 1982.
Vegeu també
modificaEnllaços externs
modifica- L'origen del nom Arxivat 2004-03-14 a Wayback Machine. (castellà)
- Los Alamos National Laboratory - Níquel Arxivat 2004-06-12 a Wayback Machine. (anglès)
- webelements.com - Níquel (anglès)
- environmentalchemistry.com - Níquel (anglès)